综述 | 肠道微生物群、代谢产物和宿主免疫(IF:41.982)
| 导读 | 论文ID原名:Gut microbiota, metabolites and host immunity译名:肠道微生物群、代谢产物和宿主免疫期刊:Nature reviews ... |
导读
微生物群—哺乳动物体内和体表的微生物集合—为免疫系统的发育和功能提供了重要的信号。随着微生物群落分析技术越来越普及,促使许多免疫学家投入到宿主微生物群领域的研究。微生物群落及其代谢产物和组分不仅是机体免疫稳态所必需的,而且还影响机体对许多免疫介导的疾病和失调的易感性。本文讨论了微生物组研究的技术和计算方法,以及近年来对宿主免疫和微生物共生关系的认识进展,其中重点介绍了一些特定微生物代谢产物、细菌组分和免疫系统。
论文ID
原名:Gut microbiota, metabolites and host immunity
译名:肠道微生物群、代谢产物和宿主免疫
期刊:Nature reviews immunology
IF:41.982
发表时间:2017年5月
通信作者: Wendy S. Garrett
通信作者单位:Harvard T. H. Chan School of Public Health, Boston, Massachusetts 02115, USA.
综述概况
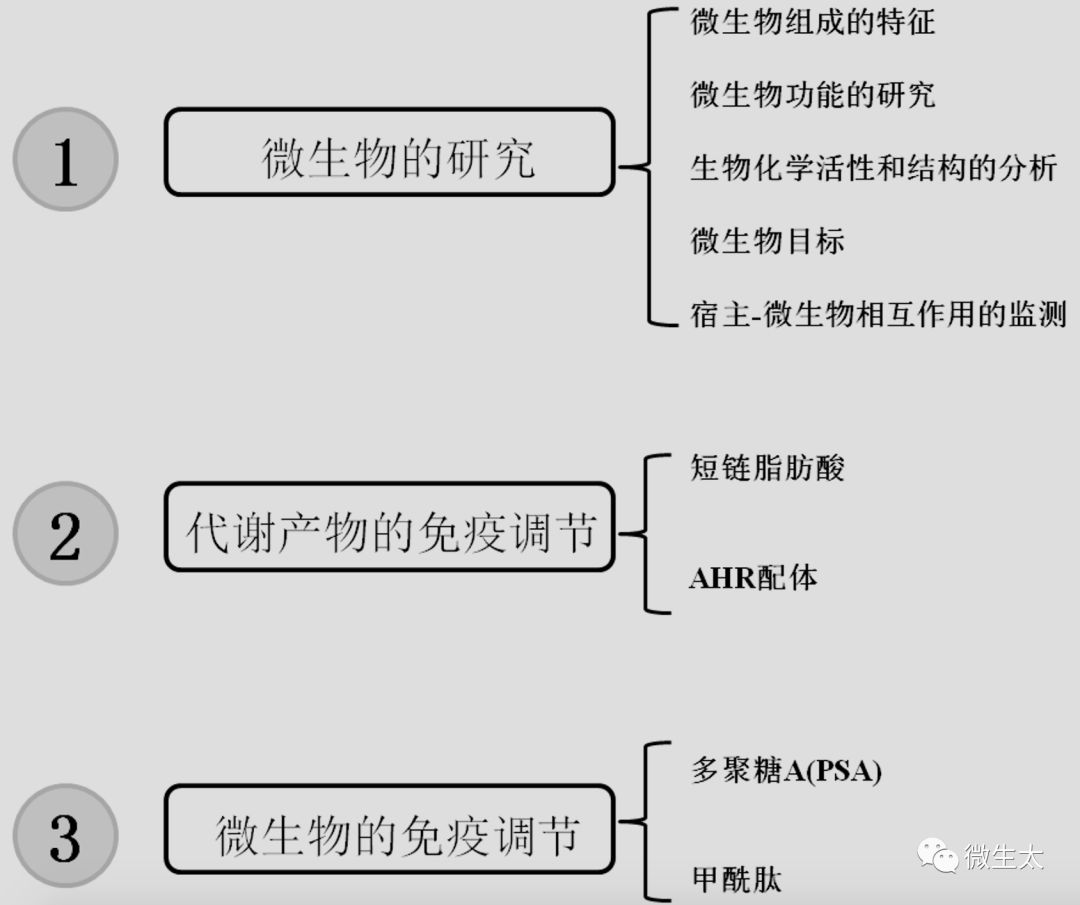
综述概况图
综述内容
微生物的研究
微生物组成的特征
高通量DNA测序技术的出现—最初是基于细菌和古细菌16S核糖体RNA扩增子序列的聚类读数,现在是将整个基因组与生命的所有领域相对应—使样本直接分类而无需培养。这些技术进步为剖析来自不同环境中的复杂微生物群落和分析群落结构随时间的变化提供了一种可靠的方法。虽然个体间微生物组的组成不同,有时在个体内部也有明显的波动,但在定植于人体的微生物群落中,其核心特征是存在的1。每个个体生存环境在空间上都是不同的,并且不同程度上由特定的门所支配,不同解剖位点上的特定生境微生物的数量和分布各不相同2。在肠道中,微生物种类的数量和多样性从胃到结肠呈纵向增加3,4,结肠是最密集和新陈代谢最活跃的社区(包括1013个微生物细胞)5。对个体内部和跨个体微生物多样性程度的认识正在影响微生物组研究的方式,从对微生物群落成员的描述性研究转变为对微生物群对健康和疾病的功能作用的机制研究。
微生物功能的研究
整个宏基因组学和元转录组测序工作(来自cDNA文库)正在定义微生物的功能潜力和实时活性,并揭示微生物代谢和宿主发育之间的相互作用。剖析微生物组的调控、动态变化以及宿主基因表达模式的能力揭示了微生物群落的功能是如何影响宿主6,反过来,宿主遗传学如何塑造微生物组的组成和功能7。而且,宿主和微生物组的宏基因组和元转录组的同时测序也为宿主和微生物群的相互作用机制以及健康和患病个体之间的差异提供了深入的见解。此外,随着鉴定和重构基因到更广泛的生物通路的研究工具的发展,已经能够把微生物组的功能特征划分为不同但相关的类别,这些类别对host8(BOX 1)的健康至关重要。
生物化学活性和结构的分析
质谱技术和色谱技术已有一个多世纪的历史;然而,它们只是最近才被应用于宿主微生物组的研究22–24。靶向和非靶向代谢组学和代谢蛋白组学策略都有望揭示合成、设计和天然微生物群落的化学多样性和充分的生化能力。然而,这些技术提出了许多与样品(特别是粪便物质)的提取和处理有关的实验挑战25,26。随着技术障碍的克服,数据分析将继续拓宽我们对微生物组对宿主生理的广泛影响的认识,为开发和测试诊断和治疗方法提供机会。
微生物目标
鉴于微生物群落的丰富性和多样性,分析这些群落中的单个物种和菌株及其相关功能是很重要的,特别是对于未能培养或低丰度的微生物27。这可以通过指定菌株特异性和从整个宏基因组测序数据组装单个基因组的方式来实现28,29,或使用混合捕获和涉及分离和测序稀有物种或单个微生物细胞(BOX 1)的单细胞法。这些方法有望能都推动改善微流体平台和软件应用程序,可以更准确地捕捉和分析微生物多样性和增强对个体遗传变异和功能贡献的理解30。
宿主-微生物相互作用的监测
随着时间的推移,新的工具和技术进步极大地促进了我们对复杂微生物群落及其与宿主的相互作用的理解,涉及到饮食、生活方式的变化以及健康和疾病的状况。然而,对于微生物如何在其首选环境生态位而不是在培养基中相互作用或与宿主细胞相互作用的认识有限。最近的两项研究解决了这一根本挑战。在第一项研究中31,荧光原位杂交(FISH)结合单细胞成像和定量分析软件,来测量肠道微生物的空间组织。饮食摄入对肠道微生物群和宿主的影响的研究表明,缺乏纤维的饮食会导致小鼠肠道内黏液层减少。失去这个防护层导致细菌与肠上皮细胞更接近,反过来,会触发机体生产抗菌肽(AMP),再生胰岛衍生蛋白3β(REG3β)。微生物可利用的碳水化合物的缺乏极大地改变了不同细菌群的聚集模式。虽然对于微生物的空间分布及其影响微生物群落结构的因素还有很多需要了解,但这种成像和分析方法为研究宿主与微生物的相互作用提供了一种新的途径。第二项研究32利用代谢低聚糖工程(MOE)和生物正交点击化学(BCC)结合全身成像技术对细菌进行体内标记和跟踪。结合这些技术,研究人员能够追踪一种共生细菌在肠道内的分布、与其他物种竞争的能力以及与宿主细胞的相互作用。这种方法有望实时研究宿主-微生物群落的相互作用,获得微生物生态位特异性的“直观的证据”,以及起源于微生物的代谢产物如何调节宿主免疫系统。
代谢产物的免疫调节
虽然宿主和微生物的代谢可以串联发生,但宿主依靠其微生物组来扩大消化酶和代谢酶的聚集33。肠道微生物群产生了极具多样的代谢物库,从到达结肠部的外源未消化饮食成分的发酵物,到微生物和宿主产生的内源性化合物。构成宿主与微生物黏膜界面的单层上皮细胞,使微生物代谢产物能够进入宿主细胞并与宿主细胞相互作用,从而影响免疫反应和疾病风险。
短链脂肪酸
未消化的复合碳水化合物是结肠细菌发酵的丰富底物,其主要代谢终端产物为短链脂肪酸(SCFAs),包括乙酸、丁酸和丙酸。肠内SCFA浓度(可达20 - 140mm)34取决于微生物组成、肠道转运时间、SCFAs的宿主-微生物代谢通量以及宿主饮食中的纤维含量。这些微生物产生的代谢物不仅是肠道菌群自身的重要能量来源,也是肠上皮细胞(IECs)的重要能量来源。SCFAs除了作为能量产生的局部底物外,还具有多种调控功能,其对宿主生理和免疫的影响还有待进一步揭示(图1)。
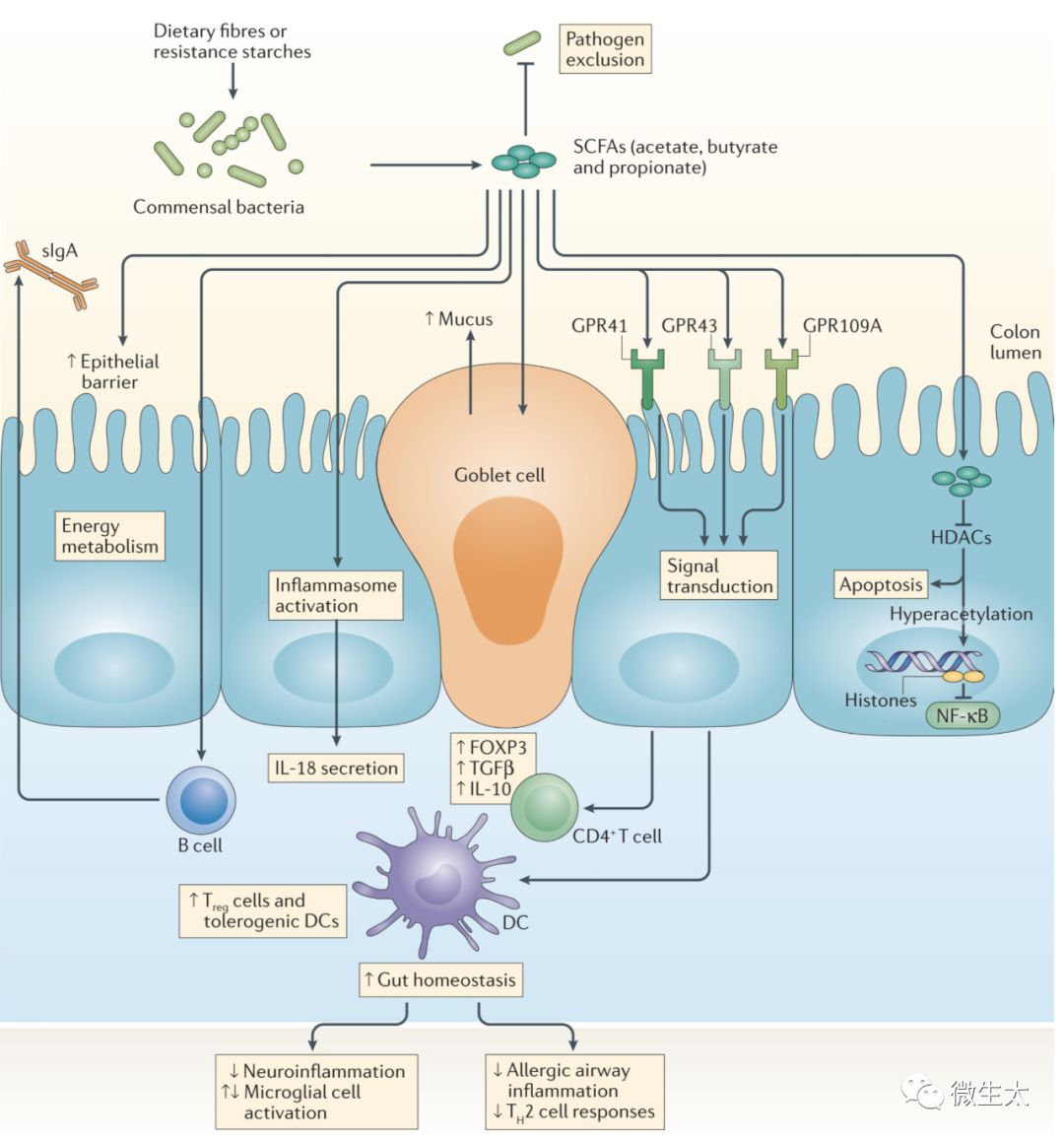
图1 SCFAs, GPCRs, 宿主生理和免疫。短链脂肪酸(SCFAs)—例如丁酸,丙酸和乙酸—是通过未消化或部分消化的膳食纤维经结肠微生物发酵产生,并且对宿主免疫系统发育和功能具有广泛影响。SCFAs结合在上皮细胞和免疫细胞(未显示)表面上的G蛋白偶联受体(GPCR),例如GPR41,GPR43和GPR109A。SCFA转运或扩散到宿主细胞中导致它们的代谢物和/或组蛋白脱乙酰酶(HDAC)活性抑制。SCFAs的作用是多方面的,包括增强的上皮屏障功能和免疫耐受性,其通过特定机制促进肠内稳态:通过肠杯状细胞增加粘液产生; 抑制核因子-κB(NFκB);激活炎性体并随后产生白细胞介素-18(IL-18);通过B细胞增加IgA(sIgA)的分泌;T细胞活化分子在抗原呈递细胞(如树突状细胞(DC))上的表达降低; 结肠调节性T(Treg)细胞的数量和功能增加,包括forkhead box P3(FOXP3)的表达和抗炎细胞因子(转化生长因子-β(TGFβ)和IL-10)的产生。SCFA还能到达其他器官,例如脑和肺,其中它们直接或间接作用于局部或驻留的抗原呈递细胞,以分别减少与神经炎症和过敏性气道疾病相关的炎症反应。
SCFAs是组蛋白去乙酰化酶(HDACs)的抑制剂和G蛋白偶联受体(GPCRs)的配体,因此作为影响造血和非造血细胞系的扩张和功能的信号分子。SCFAs对HDACs的抑制往往促进一种致耐受性,这是对维持免疫稳态至关重要的抗炎性细胞表型并且该活性支持微生物群可以作为宿主生理学的表观遗传调节剂的概念。外周血单核细胞和中性粒细胞暴露于SCFAs,类似于暴露于HDAC抑制剂,灭活nuclear factor-κB (NF-κB)和下调促炎细胞因子tumour necrosis factor (TNF)35,36。进一步的研究将SCFAs抑制HDAC的抗炎作用扩展到巨噬细胞37,38和树突状细胞39,40。总的来说,这些结果证明SCFA诱导的HDAC抑制调控了NF-κB的活性和促炎固有免疫反应。
SCFAs还通过HDAC抑制作用影响外周T细胞,特别是调节T (Treg)细胞。HDAC抑制剂可以改变Treg细胞在体内的频率和功能。HDAC9的抑制确实增加了forkhead box P3 (FOXP3)的表达和Treg细胞的数量,增强了FOXP3+Treg细胞在稳态条件下的抑制功能,并放大了Treg细胞介导的小鼠结肠炎的抑制作用。研究表明,特异性SCFAs具有调节结肠FOXP3+ Treg细胞池大小和功能的能力,而且SCFA能以HDAC依赖性方式诱导FOXP3表达以促进结肠稳态42-44。将小鼠暴露于高纤维或SCFA补充的饮食,不仅可以抑制结肠炎症,还可以通过提高FOXP3+Treg细胞的抑制活性来抑制过敏性气道疾病。母体摄入富含SCFA的饮食可以将抑制作用传递给后代,表明SCFAs在免疫系统发育和疾病保护中的表观遗传潜力。已经在几种炎性疾病动物模型中描述了HDAC抑制剂的免疫调节作用和治疗益处,部分是通过增强FOXP3+Treg细胞的调节功能46-48。这些研究还发现了介导SCFAs对宿主免疫作用的其他机制,包括GPCRs的参与。
SCFAs的许多调控特性需要通过GPCRs进行信号转导,包括GPR43(也称为FFAR2)、GPR41(也称为FFAR3)和GPR109A(也称为HCAR2),它们在多种类型的细胞中表达,包括免疫细胞和IECs。GPR43的表达对于SCFA诱导的中性粒细胞趋化36和Treg细胞的扩增和抑制功能是必要的44。在葡聚糖硫酸钠损伤模型(DSS诱导的损伤模型)和T细胞转移结肠炎模型中, 通过增强的诱导型FOXP3 + Treg细胞的频率和功能,饮用水中补充SCFAs减轻了野生型小鼠的疾病而在Gpr43-/-小鼠中没有44,49。在肠道外,SCFA-GPR43相互作用通过减少中性粒细胞中的趋化性和炎性基因表达来降低细菌诱导的早产的风险50,并且通过介导炎症和免疫细胞清除尿酸单钠晶体来下调痛风相关的炎症51。
SCFAs对宿主生理的GPR43依赖效应也延伸到中枢神经系统(central nervous system, CNS)。小胶质细胞是中枢神经系统的常驻巨噬细胞,其成熟和功能依赖于肠道菌群,维持小胶质细胞的稳态需要SCFAs和GPR43(REF. 52)。其他SCFA敏感的GPCRs对宿主免疫功能也至关重要。在野生型小鼠而不是Gpr41−/−小鼠中, SCFAs阻断DC成熟并改善过敏性气道炎症40。SCFA介导的GPR109A受体(GPR109A对烟酸和丁酸均有反应)的活化,通过单核细胞增加抗炎效应分子的表达,诱导Treg细胞分化和白细胞介素-10 (IL-10)产生T细胞,从而阻止结肠炎和结肠癌的发生。然而,SCFAs可使疾病恶化。一项测量囊性纤维化患者痰中SCFA浓度的研究发现,SCFA介导的中性粒细胞聚集,加重炎症反应并促进铜绿假单胞菌的生长54。因此,SCFAs的免疫调节作用取决于研究的环境和细胞类型。GPCRs细胞特异性和组织特异性的存在,以及它们不同的代谢产物感知能力,使宿主能够调节炎症,控制感染或损伤,维持体内平衡。
SCFAs通过增强IEC屏障功能,对维持粘膜免疫也是必不可少的。肠上皮杯状细胞对SCFAs的反应是上调黏液基因的转录55,56,并将由SCFA产生的Bacteroides thetaiotaomicron 或Faecalibacterium praus-nitzii 接种于无菌小鼠,诱导杯状细胞分化和黏液生成57。SCFA还改变了IEC的紧密连接渗透性。能产生高浓度醋酸盐的Bifidobacterium longum菌落的定植,可防护肠致病性大肠杆菌O157:H7感染,表明SCFAs可增强IEC完整性,抑制致命毒素从肠腔转移到全身循环58。SCFAs与IECs上的GPR43和GPR109A结合也激活了炎性小体,并增加了下游炎性细胞因子IL-18的产生(REF. 59),从而预防了易产生结肠炎表型的发生。总的来说,这些观察结果突出了微生物来源的SCFA在调节局部和全身免疫反应以及维持粘膜体内平衡中的作用。SCFAs是一种半衰期短、代谢快的挥发性化合物,其对HDACs的抑制作用是浓度依耐性。只有高毫摩尔SCFA浓度才足以干扰HDAC功能61,其作用可能需要特定的转运体39。然而,SCFAs也可以通过GPCR依赖机制间接抑制HDACs, GPCRs对SCFA特异性不同,反过来SCFAs的作用也不同。因此,SCFAs是否直接或间接阻断HDAC活性受多种因素的影响,包括浓度、转运体、受体以及所涉及的细胞和/或组织类型。因此,研究SCFAs在健康和疾病中的免疫调节功能和治疗潜力还需要更多的研究。
AHR配体
肠道微生物群的成员及其特定膳食成分代谢所产生代谢物,可以结合宿主细胞上的芳烃受体(AHR)。AHR是一种配体诱导型转录因子,由免疫细胞、上皮细胞和一些肿瘤细胞表达。AHR最初被认为是在异种生物代谢中起作用,但也有证据表明它在调节粘膜免疫反应中的作用。小鼠体内缺乏AHR或缺乏AHR配体,会导致肠道微生物组成受到干扰(即富含拟杆菌的细菌腔负荷增加),AMP产量、肠上皮内淋巴细胞(IELs)数量和IECs转化率下降63。将野生型小鼠的IELs转移至Ahr-/-小鼠,恢复了IEC屏障功能并使细菌负荷正常化63。在野生型小鼠中,缺乏AHR配体增加了DSS诱导的结肠炎症的严重程度,当给小鼠补充含合成AHR配体的饮食时,该症状减弱63。综上所述,这些研究表明肠道免疫细胞亚群对AHR有内在的要求,因为AHR活性的缺乏会使宿主容易受到增强的免疫激活和免疫病理的影响,而特定饮食成分的微生物代谢对于适当的AHR信号和宿主-微生物共生至关重要。
AHR的激活受饮食和肠道微生物群组成的影响。只有某些细菌亚群,尤其是Lactobacilli spp.,才能代谢膳食色氨酸并产生能刺激ILC3s的AHR配体。ILC3s诱导的IL-22的产生驱动了AMPs的表达,AMPs通过隔离金属离子来抑制病原菌的适应度,从而降低了它们对病原菌的可用性,如Opportunistic fungus Candida albicans65。因此,内源性微生物来源的色氨酸代谢物可能为宿主提供线索,这些线索对于抵抗定植和预防粘膜炎症至关重要。最近的证据表明,AHR具有物种依赖性的配体结合偏好66,表明宿主常见的配体与其微生物群之间的共同进化,作为AHRs的配体,微生物产生的代谢物对宿主免疫至关重要,尤其是在粘膜界面的炎症保护方面。同时值得进一步研究=其作为感染性和炎性疾病治疗的潜力。
微生物的免疫调节
先天免疫系统遇到丰富多样的自身和非自身抗原,并配有种系编码的模式识别受体(PRR),以监测,协调和响应微生物形态的变化。PRR检测细菌,真菌和病毒来源的微生物相关分子模式(MAMP),包括脂多糖,鞭毛蛋白,肽聚糖,甲酰肽和独特的核酸结构。跨膜和胞质的PRRs启动保守的信号级联,驱动对宿主防御至关重要的刺激或调节效应反应。PRR信号通路的激活导致AMPs、细胞因子、趋化因子和凋亡因子的产生,信号通路的中断或改变可能有助于疾病发生。阐明许多微生物产物如何影响PRR介导的反应有助于理解宿主和微生物稳态的发展和维持(图2)。在这里,我们专注于三个主要的MAMPs—多糖(PSA),甲酰肽和D-glycero-β-D-manno-heptose-1,7- bisphosphate (HBP)—这有助于理解宿主和微生物的共生和从宿主和微生物相互作用中实现新的治疗机会。
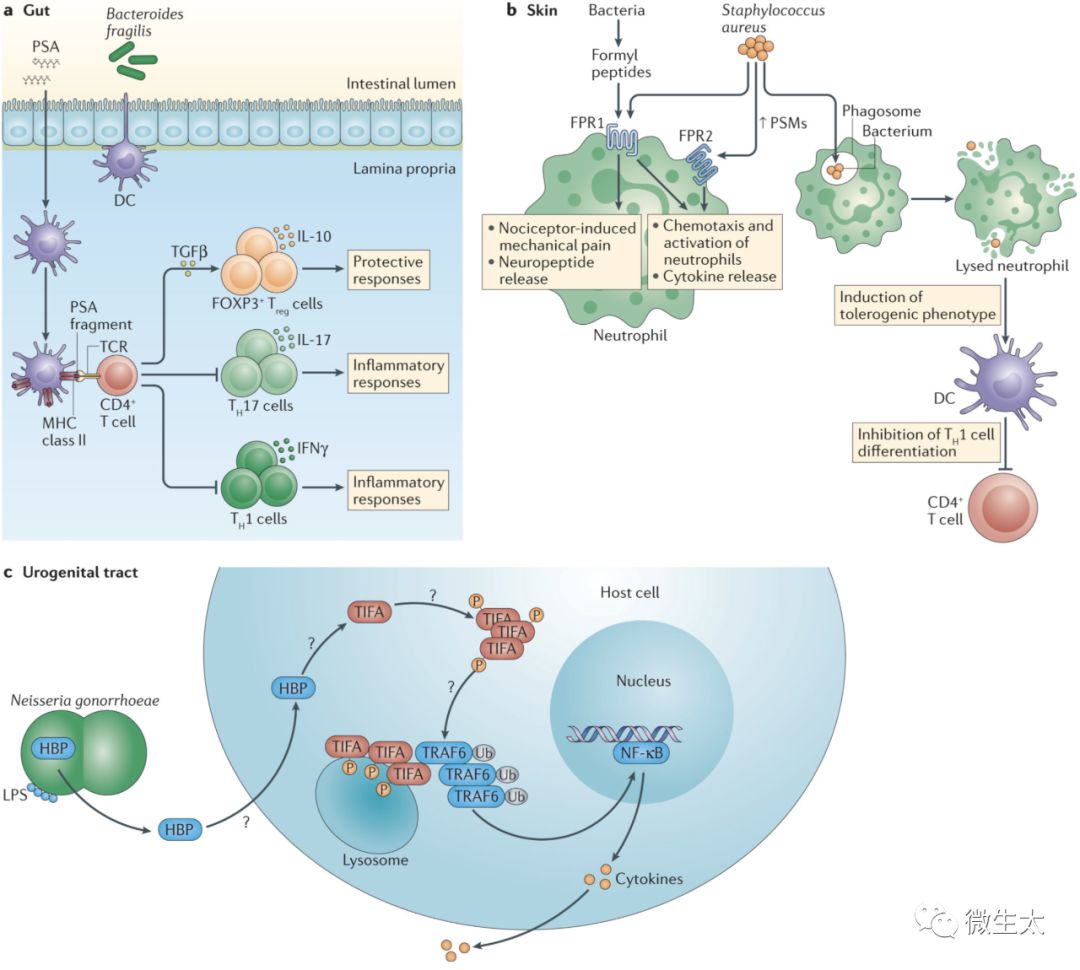
图2 微生物组分PSA,甲酰肽和HBP的免疫调节。到目前为止,已经鉴定了几种与非经典模式识别受体(PRR)相关的细菌因子,包括多糖A(PSA),甲酰肽和D glycero-β-D-manno-heptose-1,7-biphosphate(HBP)。a:来自Bacteroides fragilis的PSA可以改变脾脏中的CD4+T辅助细胞1(TH1)-TH2细胞平衡(未显示)并且改变外周效应T细胞亚群的平衡。在肠道中,PSA由固有层树突细胞(DC)吸收,并加工并呈递给初始CD4+T细胞。活化的转化生长因子-β(TGFβ)诱导抗炎forkhead box P3(FOXP3)+调节性T(Treg)细胞的扩增和白细胞介素-10(IL-10)的产生,其抑制炎性TH1和TH17细胞的活性。b:由所有细菌释放的甲酰肽结合甲酰肽受体(FPR),其是在中性粒细胞和其他免疫细胞上发现的G蛋白偶联受体。来自金黄色葡萄球菌的甲酰基肽可通过FPR1发出信号,并有助于伤害感受器驱动的机械性疼痛的激活和免疫抑制性神经肽的释放。在高纳摩尔浓度下,金黄色葡萄球菌衍生的甲酰基肽(称为酚可溶性调控蛋白(PSMs))通过与FPR2结合而刺激大量中性粒细胞流入感染部位。诱导的中性粒细胞活化导致氧化应激的爆发。PSM通过在DC中诱导致耐受性表型并抑制TH1细胞的分化来影响适应性免疫系统。金黄色葡萄球菌还可以通过PSM避开吞噬溶酶体,裂解宿主细胞和分散生物膜,并且还可以杀死竞争细菌(未显示)。HBP是由革兰氏阴性细菌在脂多糖(LPS)生物合成期间产生并在宿主细胞的胞质溶胶中检测到的单糖。由细胞外病原体淋病奈瑟氏球菌分泌的HBP通过TIFA的磷酸化依赖性寡聚化反应诱导先天和适应性免疫应答。TIFA的激活及其随后与TNF受体相关因子6(TRAF6)的相互作用,导致TRAF6泛素依赖性核因子-κB(NF-κB)的激活,从而诱导促炎免疫基因的表达。IFNγ,干扰素-γ; P,磷酸盐; TCR,T细胞受体。
PSA
PSA是八种结构不同的荚膜多糖之一,由Bacteroides fragilis(一种革兰氏阴性共生体,主要存在于结肠的外部粘液层中)产生和输出。这种两性结构对B. fragilis 的生长和有效定植至关重要,并介导其与其他微生物成员和宿主的相互作用。PSA对先天和适应性免疫细胞具有多效性调节作用。PSA与DC上的Toll样受体2(TLR2)相互作用82,并通过CD11c+DCs对其进行取样,处理和呈递给T细胞83,84; 因此,给予PSA可以纠正在无菌小鼠中观察到的T辅助1(TH1)细胞和TH2细胞之间的不平衡83。在脓肿形成和结肠炎的临床前模型中,PSA可以通过激活CD4+T细胞驱动IL-10的产生85,并通过增强IL-10产生CD25+FOXP3+Treg细胞的群体频率和功能来抑制炎症86。虽然PSA在脾脏和胃肠道中得到了广泛的研究,但其抗炎活性却超出这些区域。在神经炎症中,PSA对Treg细胞的作用需要诱导CD39(也称为NTPDase 1)表达,使Treg细胞迁移到CNS87。CD39是一种重要的调节酶,通过将促炎的胞外ATP转化为低炎症的ADP来限制炎症。CD39表面表达是区分人类FOXP3+Treg细胞与初始T细胞或其他效应T细胞群的标志,而人类FOXP3+ Treg细胞上调CD39表达是其抑制活性的必要条件88。近期对人外周血单核细胞的体外研究表明,PSA可增强IL-10产生CD4+ CD39+ FOXP3+Treg细胞的扩增和抑制功能89。Treg细胞中CD39缺乏与无法抑制实验性结肠炎有关,炎症性肠病患者中CD39表达增加与疾病缓解相关90。总之,临床前模型和体外人体细胞实验的机制研究表明,PSA可能是治疗人类自身免疫性疾病的一种有用的免疫调节MAMP。
甲酰肽
由甲酰基肽受体(FPRs)识别的保守的N-甲酰基肽基序存在于细菌中,其密切相关的基序存在于线粒体中。FPRs还可以检测到其他非甲酰化内源性配体,包括血清淀粉样蛋白A,导管素抗菌肽LL-37和蛋白质膜联蛋白A1。FPRs的刺激导致白细胞的募集和促炎细胞因子、酶和过氧化物的产生来抗感染。FPRs由先天免疫细胞、上皮细胞、内皮细胞、肌肉细胞和神经细胞表达,近期研究表明,FPRs对非吞噬细胞的刺激是实现感染或损伤后组织稳态的必要条件19。鉴于FPRs的不同作用和表达谱,FPR异常激活在炎症、自身免疫性疾病、神经退行性疾病和癌症中的作用已被描述。
致病性金黄色葡萄球菌(Pathogenic S. aureus)产生甲酰肽,称为酚可溶性调控蛋白(PSMs)。哪些FPR被PSMs激活取决于PSMs的长度和二级结构,而FPR激活的强度取决于PSM的浓度92。在低水平时,PSMs通过FPR1呈现弱信号,但在高水平时,PSMs是FPR2的强激活剂,诱导显着的中性粒细胞流入感染部位并对宿主细胞和竞争性微生物细胞造成细胞毒性损伤93。FPRs还可与痛觉感受器共同作用,介导金黄色葡萄球菌引起的炎症性疼痛。来源于金黄色葡萄球菌的甲酰基肽通过FPR1,有助于激活伤害感受器驱动的机械性疼痛和免疫抑制性神经肽的释放94。金黄色葡萄球菌还能分泌一些蛋白来抑制FPRs和阻断白细胞迁移95,96。综上所述,这些研究表明,金黄色葡萄球菌通过刺激痛觉感受器释放免疫抑制神经肽,间接抑制宿主免疫系统,并通过FPRs直接抑制,从而允许细菌在感染组织中传播。在感染的后期,随着PSMs的积累,金黄色葡萄球菌可以增强中性粒细胞的细胞毒性活性,进一步损伤宿主细胞和组织。致病性金黄色葡萄球菌的研究突出了宿主对MAMP识别的重要性,以及在疾病早期激活先天免疫反应的新策略的必要性。鉴于甲酰基肽能够有效激活先天免疫系统,肽脱甲酰基酶抑制剂(如放线菌素)是治疗金黄色葡萄球菌等耐药细菌有前途的疗法97。许多细菌编码肽脱甲酰基酶,这些酶的调控是细菌在感染过程中灭活甲酰基肽并阻断白细胞趋化的机制。甲硫氨酰-tRNA甲酰转移酶(一种引发参与蛋白质合成的甲硫基-tRNA甲酰化反应的酶)在金黄色葡萄球菌中基因失活或化学抑制,从而降低其在体内产生强烈感染的能力98。
尽管放线菌素可以驱动在细菌病原体中甲硫氨酰-tRNA甲酰转移酶的功能缺失突变,并对肽脱甲酰基酶抑制剂产生耐药性,这些突变导致体外和体内状态的显著降低99,从而为管理金黄色葡萄球菌感染提供了一种有效的策略。
结 论
微生物群和免疫系统参与了一个复杂的信号交错,受到无数环境因素的影响,它们在身体的局部和全身相互作用。微生物产生的代谢物及其细胞和分子组分正日益被认为是人类生理的重要组成部分,对免疫功能及功能紊乱有着深远的影响。微生物代谢产物是通过微生物、微生物和宿主及微生物相互作用产生的,这种协同代谢在人类健康和疾病中的作用越来越受到重视。这些观察结果支持了哺乳动物是依赖宿主和微生物基因组(即全基因组)来实现最佳功能的共生功能体这一概念。元组学和不断发展的计算框架有望引导系统预测和发现更多与免疫系统功能相关的微生物代谢产物和组分。然而,进一步探究已知的微生物代谢产物(如SCFAs)和副代谢产物(如多胺和AHR配体)如何影响免疫细胞亚群及其功能也很重要。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发