“狙击手”蛋白:安全无害,让癌细胞无处遁形!
| 导读 | 研究发现通过识别过度活跃的生物通路而设计的合成蛋白质可以杀死癌细胞。 |
作者:Paris
近日,《Science》杂志在线发表了来自斯坦福大学医学院的研究人员的研究论文“A compact synthetic pathway rewires cancer signaling to therapeutic effector release”。他们发现,通过识别过度活跃的生物通路而设计的合成蛋白质可以杀死癌细胞,同时挽救健康细胞。

在恶性肿瘤发生发展的过程中,存在着一类蛋白质(通常是突变的基因片段所表达的),它们的存在,会使正常组织、细胞发生癌变,或者促进肿瘤的生长及转移。一旦让这些蛋白质(或基因片段)失去活性,就会阻断肿瘤细胞生长或者转移的进程,控制恶性肿瘤的发展,从而达到治疗肿瘤的目的。
于是,科学家们不断研制出针对这些蛋白质(或者基因片段)的药物,这些药物一旦进入人体,就如同导弹寻找“靶子”一样,直接对这些蛋白质(或者基因片段)进行“攻击”,使得这些蛋白质(或者基因片段)不再成为恶性肿瘤发展的“幕后推手”,使肿瘤得到控制。这种治疗模式,就叫做“靶向治疗”。
癌细胞与正常细胞的不同之处在于癌细胞处于一种不受控制的增殖和存活能力,是一种细胞内信号传到改变导致的突变,通过癌症的靶向药物可以抑制其信号传导,然而有些药物也会受到毒副作用的限制从而抑制正常信号。
为了解决靶向治疗的副作用问题,科学家致力于寻求更两全其美的方法:既能够靶向杀死癌细胞,又不损害正常细胞。而他们设计的合成蛋白质则近乎完美地解决了目前的僵局。斯坦福大学的研究人员将这种通过设计合成蛋白的方法称之为“RASER”,该方法仅依赖于两种蛋白质:
第一种:由两种天然蛋白质融合在一起——其中包含一种能与活性ErbB()受体结合天然蛋白质,另一种能分裂特定氨基酸序列的天然蛋白质。第二种:与细胞膜的内表面结合,并包含一个可定制的“货物”序列,可以在细胞内执行特定的动作。当第一种蛋白与活跃的ErbB受体结合时,它会切断第二个蛋白并将货物释放到细胞内部。
ErbB 受体信号通过 Akt、MAPK 以及其他多种通路来调节细胞增殖、迁移、分化、凋亡以及细胞移动。在多种形式的恶性肿瘤中,ErbB 家族成员以及其部分配体通常过表达、扩增或突变,这使其成为重要的治疗靶标。ErbB受体在体内分布广泛,在不同种类的实体瘤尤其是来源于外胚层的肿瘤中(前列腺癌、乳腺癌、卵巢癌、头颈部肿瘤等)有高水平表达。
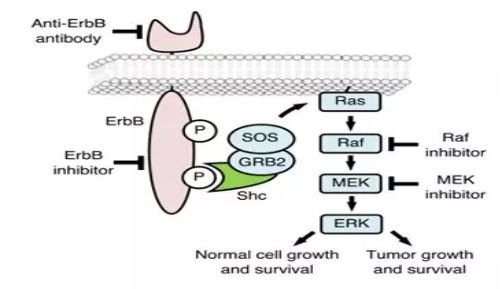
ErbB受体信号通路
“当受体蛋白一直处于激活状态时,就像在癌细胞中一样,释放的蛋白会随着时间累积,”Chung说,“最终积累到足以对细胞产生影响。通过这种方式,该系统只对癌细胞产生影响,我们可以通过选择‘载货’蛋白,将受体一直处于开启状态的状态转化为不同的结果。”
第一次测试,他们选择使用参与触发细胞死亡的蛋白质作为RASER货物。研究小组将RASER系统与目前用于转移性乳腺癌的两种疗法进行了比较:
① ErbB过度活跃的乳腺癌和肺癌细胞;
② ErbB活性正常的乳腺癌细胞和非癌症的乳腺和肺细胞系。
结果发现传统化疗方案不加选择地杀死所有细胞,而RASER能够特异性地杀死ErbB路径中过度活跃的细胞,同时留下了ErbB活性正常的细胞。
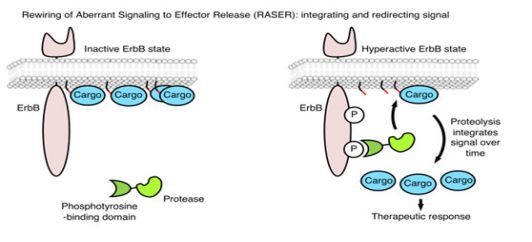
RASER系统
在不断改进、完善试验之后,研究人员发现,“将异常信号重新连接到效应物释放”(RASER)的新系统,对依赖于ErbB受体活性的癌细胞具有高度特异性。该系统只对癌细胞产生影响,如此一来,我们可以根据合成的蛋白质来提供高度针对性和可定制的治疗方法,并且可以避开当前治疗方法的破坏性副作用。
接下来还有很多工作要做,比如如何更好地将合成蛋白导入肿瘤,以及了解免疫系统对RASER的反应等,该研究无疑为无毒副作用的癌症治疗奠定了基础。(转化医学网360zhyx.com)
参考文献
Hokyung K. Chung, Xinzhi Zou, Bryce T. Bajar A compact synthetic pathway rewires cancer signaling to therapeutic effector release
推荐内容
国际癌症大会报名通道

为了回馈转化医学网忠实用户,现在起报名参加第二届上海国际癌症大会,前50名可享受半价优惠。识别这个二维码就可以报名了!
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发