肿瘤代谢,这些最新研究值得你关注
| 导读 | 代谢组学的研究对象是内源性代谢物质(中间或代谢终产物),通过分析这些代谢物质在体液及组织内的变化规律,可以从生物整体分析基因表达,蛋白质调节等内外因素对机体状态的影响,机体内任何生理、病理或其他因素的变化都会影响代谢物的浓度或使代谢流发生改变,因此代谢组学技术能更真实地反映机体的实际情况。 |
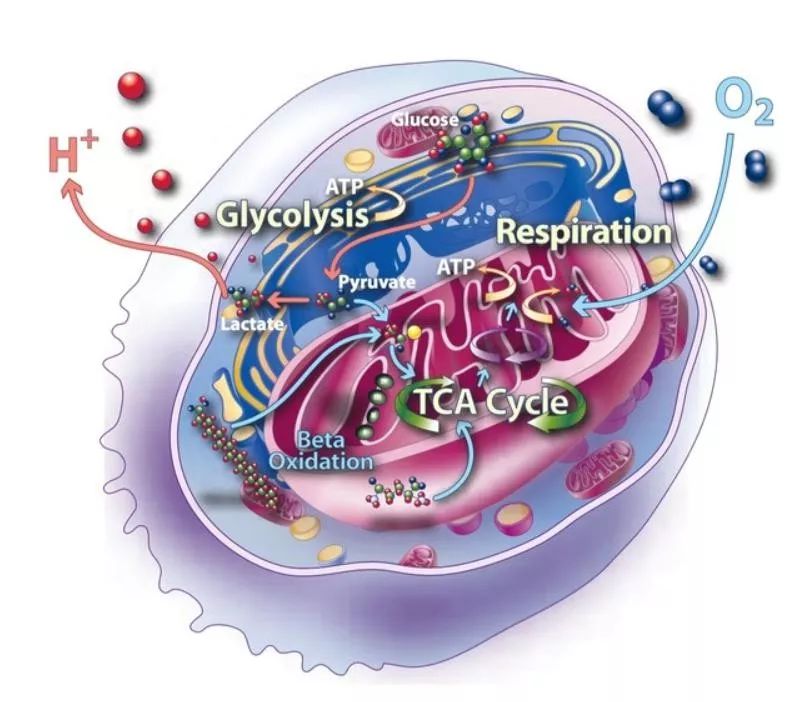
代谢组学的研究对象是内源性代谢物质(中间或代谢终产物),通过分析这些代谢物质在体液及组织内的变化规律,可以从生物整体分析基因表达,蛋白质调节等内外因素对机体状态的影响,机体内任何生理、病理或其他因素的变化都会影响代谢物的浓度或使代谢流发生改变,因此代谢组学技术能更真实地反映机体的实际情况。在近一个世纪前,科学家们发现了肿瘤代谢改变的特征,过去的十几年中肿瘤代谢研究成为令人瞩目的新领域。这篇文章对近期肿瘤代谢研究做了总结,希望能对大家有所帮助。
研究揭示揭示肿瘤氨代谢异常的分子机制及功能
研究者发现,肿瘤抑制因子p53调控着肿瘤细胞内介导氨代谢的尿素循环。p53缺失或突变的肿瘤细胞或小鼠体内表现出高水平的尿素循环代谢酶(Carbamoyl Phosphate Synthetase 1, Ornithine transcarbamylase 和 Arginase 1)的表达和氨基酸的合成。体内、体外的数据表明,p53对尿素循环的抑制导致了氨的积累和肿瘤生长的抑制,且氨的累积可反馈激活p53。值得一提的是,尿素循环的代谢酶的表达和功能具有组织依赖的特性,而p53选择调控了该循环途径中一半以上的反应步骤,这表明,对于氨代谢的调控可能是p53影响肿瘤发生发展的一个重要的分子机制。
进一步研究发现,多胺合成途径中的限速酶ODC (ornithine decarboxylase,鸟氨酸脱羧酶)的活性与p53的表达,尿素循环的活性,以及氨积累呈显著负相关。p53抑制尿素循环代谢途径导致的氨累积,可直接下调ODC的mRNA翻译,进而导致细胞内总体ODC的活性降低,使得多胺合成受阻,减慢肿瘤细胞的增殖。
这首次将p53与氨代谢直接联系起来,并揭示了氨的过度积累可以被ODC的蛋白翻译过程所“感知”,具有调控多胺合成,从而影响肿瘤细胞增殖的生物学功能。
微环境外泌体lncRNA调控肿瘤代谢重编程
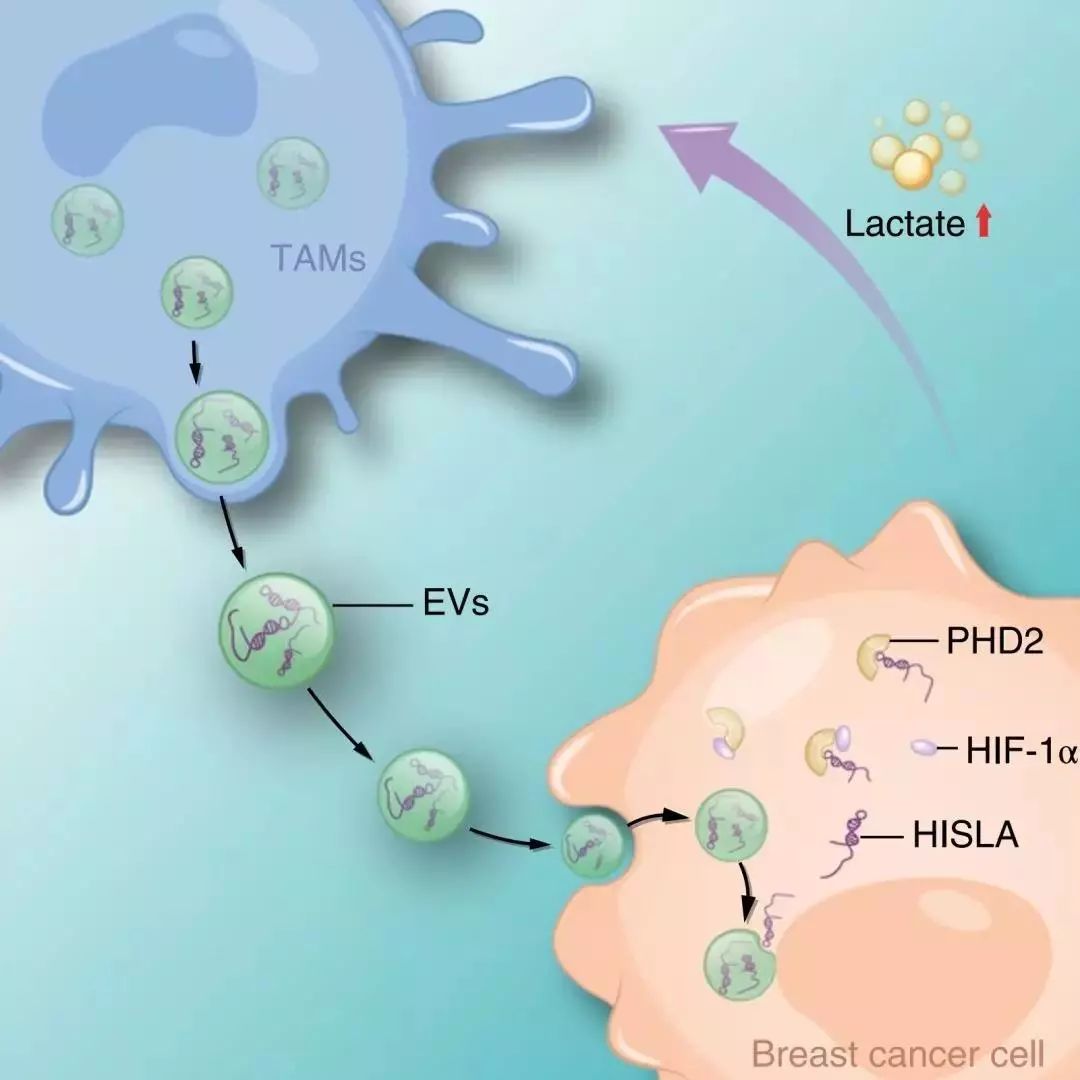
中山大学孙逸仙纪念医院宋尔卫教授作为通讯作者发表的一项研究揭示了巨噬细胞分泌外泌体所包裹的lncRNA,可作为细胞间信号传导分子调控肿瘤细胞的代谢重编程。
研究者首先通过乳腺癌组织连续切片免疫组化染色,发现在肿瘤中心的缺氧地带肿瘤细胞具有显著的有氧糖酵解现象。不仅如此,在肿瘤的边缘氧供充分的位置,肿瘤细胞仍可能表现出显著的有氧糖酵解状态,而糖酵解的存在与肿瘤细胞的凋亡水平呈显著负相关。而且,在肿瘤边缘有氧糖酵解显著的肿瘤细胞周围往往伴随着大量巨噬细胞的浸润,表明肿瘤间质中的巨噬细胞与恶性肿瘤细胞常氧状态下的有氧糖酵解存在明显的相关性。体外实验显示,从乳腺癌组织中分离得到的巨噬细胞,在与乳腺癌细胞共培养后能够显著提高乳腺癌细胞的有氧糖酵解水平,并增强乳腺癌细胞抵抗化疗药物杀伤及失巢凋亡的能力。
进一步研究发现,巨噬细胞来源的外泌体包裹着巨噬细胞所特有的长非编码RNA HISLA (HIF-1α Stabilizing Long Noncoding RNA) 被肿瘤细胞摄取后,可以将HISLA释放入肿瘤细胞中,通过抑制调控有氧糖酵解的关键转录因子HIF-1a与其羟化酶PHD2的结合来抑制HIF-1a的降解,从而维持肿瘤细胞有氧状态在HIF-1a信号的持续激活。同时,处于显著有氧糖酵解状态的肿瘤细胞可分泌大量的乳酸分子,乳酸作用于巨噬细胞可显著上调巨噬细胞中HISLA的表达,从而维持巨噬细胞来源的外泌体中HISLA的高丰度装载。
支链氨基酸的分解代谢缺陷促进肿瘤的发生发展
一项研究发现,肝癌细胞内支链氨基酸分解代谢的缺陷会造成支链氨基酸累积,从而增强雷帕霉素靶蛋白复合物-1(mTORC1) 的活性并促进肿瘤的发生发展。
研究人员使用代谢组学等方法,对肝细胞肝癌病人的癌组织样本及对应的临近区域未癌变肝脏组织样本进行分析,发现在肝细胞肝癌中支链氨基酸(BCAA)的分解代谢存在着显著的异常。参与支链氨基酸分解代谢关键途径的支链α-酮酸脱氢酶(BCKDH)复合物、酰基辅酶A脱氢酶(ACAD)的酶活性均显著降低,支链氨基酸分解酶的表达异常使支链氨基酸无法正常被分解,从而在肿瘤细胞中积累,并进一步影响病人的预后。
研究人员接着采用二乙基亚硝胺(DEN)诱导肝细胞肝癌的大鼠模型,验证了肝脏再生过程中未出现支链氨基酸含量过度积累的情况。这表明,BCAA分解代谢紊乱是肿瘤细胞的“特权”。进一步对人肝细胞肝癌及鼠肝细胞肝癌样品进行分析,结果显示BCAA的供给及其分解代谢能调节mTORC1的活性和肿瘤细胞的增殖,这表明肿瘤细胞中BCAA代谢异常有助于激活mTORC1活性。
研究者通过改变小鼠的饮食供给类型进行了一系列实验,结果发现,增强BCAA的分解代谢或者控制BCAA的摄入,可以有效抑制肿瘤的生长。
代谢组学揭示结直肠癌与肠道菌群的关系
日本东京工业大学Takuji Yamada科研团队对大队列结直肠癌(CRC)样本进行了粪便宏基因组和代谢组学研究,获得了不同阶段CRC特异性表型的微生物和代谢标志物。
本次研究对象为将有遗传性或疑似遗传性疾病的个体排除后,根据肠镜检查结果分成9组的不同阶段CRC病例:正常;少量息肉;多发性息肉样腺瘤伴低度异型增生(MP);粘膜内癌(S0);CRC I期;CRC II期;CRC III期;CRC IV期;正常,有结直肠手术史(HS)。研究获得了两种不同的的微生物组升高模式,且重点关注Atopobium parvulum和Actinomyces odontolyticus只在MP和/或S0阶段显著升高的第二种模式,因为可能是肠道菌群状态的改变使得个体易患CRC。Atopobium parvulum已被证明是产硫化氢菌的网络枢纽,但需要进一步的研究来阐明这些细菌促成肿瘤发生的确切机制。在MP阶段,脱氧胆酸盐(DCA)显著升高,此前的研究表明,DCA会导致DNA损伤和突变升高。动物研究发现,胆汁酸会导致肠道中肿瘤发生率升高。B.wadsworthia是本研究中唯一与DCA显著相关的物种,其生长受胆汁的刺激。研究显示B.wadsworthia会引起炎症,但未见B.wadsworthia与癌症发生相关的报道。本研究获得了S0阶段的宏基因组学和代谢组学标志物,并且从CRC发展的早期阶段就发现了宏基因组组和代谢组的变化,这具有病原学和诊断意义。虽然尚不清楚这些肠道菌群和代谢物是否直接导致肿瘤发生,但肠道菌群的结构性变化可能导致致癌微环境的变化。
代谢组学发现肿瘤起始细胞的“阿克琉斯之踵”
肿瘤起始细胞(tumor-initiating cells, TICs) 是肿瘤启动的“源头”,如果能定向清除肿瘤里TICs,或许会帮助我们从源头上杀死癌细胞。
近日,Nature medicine刊登了一篇名为 Methionine is a metabolic dependency of tumor-initiating cells的文章,研究者借助代谢组学和同位素示踪的分析方法,揭示了TICs具有高度激活的甲硫氨酸循环 (Methionine cycle) 的代谢特征,并且对于外源的methionine具有很强的依赖性。他们发现,用小分子抑制剂阻断甲硫氨酸循环的代谢过程,可有效降低甲基化供体SAM的水平,降低组蛋白甲基化水平,进而使TICs丧失成瘤的潜能。这为肿瘤靶向治疗开发出了新的干预靶点,并且前期的小分子抑制剂也取得了非常好的效果,未来有希望在临床上进行应用。
研究揭示肿瘤代谢抑制剂的个性化治疗
6月份,Nature Communications上发表的题为“Identification of metabolic vulnerabilities of receptor tyrosine kinases-driven cancer”的文章中,研究者以非小细胞肺癌重要的分子分型EGFR突变和FGFR扩增为例,从受体酪氨酸激酶(Receptor tyrosine kinase,RTK)入手, 运用多种稳定同位素标记的代谢组学和转录组学技术阐明了不同RTK驱动肿瘤的代谢依赖性及其转录调控的分子机制,系统证实了EGFR突变和FGFR扩增驱动肿瘤的代谢弱点。其中,EGFR突变肿瘤高度依赖丝氨酸合成通路,而FGFR扩增肿瘤依赖乳酸合成。
研究还利用人源肿瘤组织来源移植瘤PDX模型,证实了EGFR突变和FGFR扩增作为丝氨酸代谢和乳酸合成抑制剂敏感标志物的可行性,为同类代谢抑制剂的个性化治疗提供了重要信息,为代谢抑制剂敏感群体研究提供了新的思路。
参考:
1.p53 regulation of ammonia metabolism through urea cycle controls polyamine biosynthesis.
2.Extracellular Vesicle-packaged HIF-1α-stabilizing LncRNA from Tumour-associated Macrophages Regulates Aerobic Glycolysis of Breast Cancer Cells.
3.Loss of BCAA Catabolism during Carcinogenesis Enhances mTORC1 Activity and Promotes Tumor Development and Progression.
4.Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer.
5.https://doi.org/10.1038/s41591-019-0423-5.
6.Identification of metabolic vulnerabilities of receptor tyrosine kinases-driven cancer
推荐内容
将于今年10月11-13日召开的第二届上海国际癌症大会,涉及癌症代谢重编程、代谢与肿瘤微环境、脂质代谢、代谢酶的非代谢功能、CAR-T技术、新型肿瘤蛋白标记物、新型肿瘤甲基化标记物、ctDNA、CTC、代谢与表观遗传、临床转化、肿瘤免疫治疗新技术、肿瘤免疫治疗临床应用、新兴靶向治疗等内容。并且已经邀请到王红阳、詹启敏、林东昕、谭蔚泓、邵峰、宋尔卫、吕志民、李进、江泽飞、苏冰、李党生、René Bernards、Warren Leonard等70余位国内外一流专家。欢迎大家来参会!
具体阵容请看:第二届上海国际癌症大会演讲嘉宾!
往届回顾请看:2018首届国际癌症大会盛大开幕
大会设有合作单位展示区,还剩少量展位招募赞助,有意者请联系会务组
参会咨询
张琴:177 2132 5659
zhangqin@360zhyx.com
赞助合作
刘世豪:185 0160 4437
liushihao@360zhyx.com

长按识别二维码,立即报名
现在报名,可享受八折优惠哦
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发