CAR-T绝杀实体瘤?我不要你觉得,我要我觉得可以
| 导读 | 世界第一个接受CAR-T疗法的成人患者BillLudwigs(患有慢性淋巴性白血病-CLL)已经实现了9年的无癌生存。来自当时CAR-T治疗研究者—BruceL.Levine的twitter第一位接受CAR-T疗法的儿童患者Emily(患有急性淋巴细胞白血病-ALL),至今已实现7年的无癌生存。 |
世界第一个接受CAR-T疗法的成人患者Bill Ludwigs(患有慢性淋巴性白血病-CLL)已经实现了9年的无癌生存。
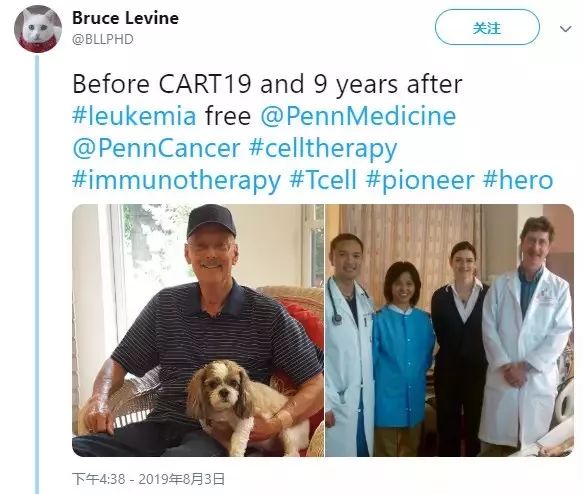
来自当时CAR-T治疗研究者—Bruce L. Levine 的twitter
第一位接受CAR-T疗法的儿童患者Emily(患有急性淋巴细胞白血病-ALL),至今已实现7年的无癌生存。

Emily在家中院里
3年前,接受CAR-T疗法的中国男孩佳辰(患有急性淋巴细胞白血病),近日检查显示白血病细胞已经消失。
CAR-T疗法,全称嵌合抗原受体T细胞免疫疗法。比之手术、化疗等经典肿瘤治疗手段,特殊之处在于利用患者自身免疫系统治疗,而非利用外来药物攻击癌细胞。理论上,只要找到合适靶点,疗法对大部分类型癌症都有效,并可对癌细胞的变化迅速作出反应。
在CAR-T疗法中,患者的身体成为“药厂”。专业人员从患者血液内分离出部分T细胞后,将通过基因技术等对T细胞实行改造,使其能够识别肿瘤细胞高剂量表达的相关抗原,成为CAR-T细胞。CAR-T细胞经体外扩增,再被回输到患者体内,理论上它可与肿瘤相关抗原结合,实现精准打击。
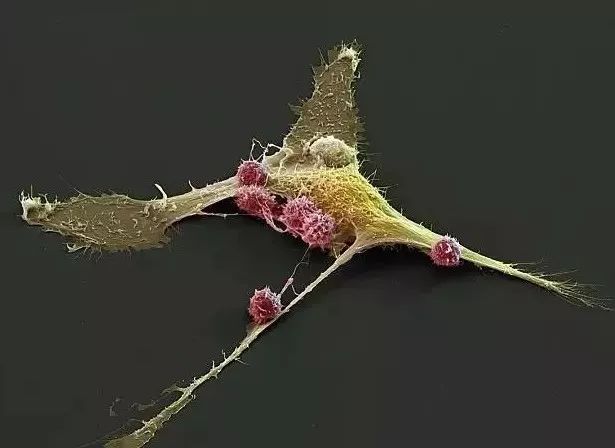
以多欺少:多个CAR-T细胞(粉红)一拥而上攻击癌细胞(黄色)!
CAR-T疗法在治疗血液肿瘤方面表现优异,但面对实体肿瘤,就有点招架不住了。
目前在治疗实体瘤方面,CAR-T疗法尚未获得突破性进展。但是近期的几个关于实体瘤的研究为CAR-T疗法打开了新思路,在小鼠试验中,实现了对肿瘤的绝杀!有理由相信,假以时日,这些研究会为肿瘤治疗开拓一个新的局面。
利用可产生双特异性抗体的新型CAR-T细胞进行治疗,使80%小鼠的脑内肿瘤完全消失!
7月份《Nature Biotechnology》发表的一篇论文中,来自哈佛医学院麻省总医院的科学家展示了一项抗击大脑恶性肿瘤的研究结果。他们结合两种抗癌新技术,对胶质母细胞瘤展开有效攻击。利用可产生双特异性抗体的新型CAR-T细胞进行治疗,在80%的小鼠中,脑内的肿瘤完全消失!
胶质母细胞瘤是最常见的大脑恶性肿瘤。这种癌症侵略性极强,会迅速恶化,确诊后留给患者的时间平均只有15个月左右,5年生存率低于10%,论凶残程度,胜过被称为“癌中之王”的胰腺癌!
胶质母细胞瘤的细胞表面,有特殊的受体分子可以作为识别抗原。比如,突变形式的表皮生长因子受体EGFRvIII。这些“致癌受体”介导了异常的生长因子信号通路,驱动癌细胞不受控制地疯长。理论上说,可以让CAR-T细胞去识别EGFRvIII,对胶质母细胞瘤发起攻击。
但由于肿瘤的异质性,这些癌细胞的分子特征不尽相同,使得CAR-T疗法针对实体瘤的效果差强人意。就像在胶质母细胞瘤中,还有很多细胞不表达突变形式的EGFR,却大量表达正常的EGFR,它们同样会放大生长信号,造成肿瘤疯长。这时候,光靠识别EGFRvIII的CAR-T细胞还不能击退肿瘤。
时势造英雄!新型免疫疗法——双特异性T细胞接合器(BiTE)闪亮登场。所谓的“双特异性”,就是可以同时靶向两个分子,它就像两个分子挂钩,一个咬住肿瘤细胞EGFR,另一个咬住效应T细胞上的表面抗原,把T细胞激活,使之产生能杀伤肿瘤的蛋白质。
但BiTE要发挥作用,还有一个问题需要解决:胶质母细胞瘤位于脑中,抗体得通过血脑屏障才能起效,这对于分子量较大的BiTE有难度。为此,研究团队大开脑洞。他们把表达BiTE的基因导入CAR-T细胞,当T细胞进入大脑后,再持续产生BiTE“咬住”肿瘤细胞。
主题研究工作完成,接下来就是检验成果的时候了。研究团队在胶质母细胞瘤小鼠模型中检验了这种新CAR-T细胞的治疗潜力。他们在免疫缺陷型小鼠脑中植入了人脑胶质瘤细胞,然后把分泌BiTE的CAR-T细胞注入小鼠体内,同时靶向表达EGFRvIII和EGFR的肿瘤细胞予以打击。经过3周时间,80%的小鼠表现出了“完全缓解”,体内已经看不到肿瘤!
Science : 肿瘤疫苗与CAR-T疗法的完美结合,绝杀体内所有肿瘤细胞!
有研究人员把CAR-T在实体瘤治疗中的局限性归结于肿瘤环境的免疫抑制状态,他们认为一旦CAR-T细胞进入到这种环境,就会产生免疫抑制,无法攻击肿瘤。基于此,研究人员研制出针对解决T细胞免疫抑制状态的肿瘤疫苗。
该疫苗能够在淋巴结区域提前激活T细胞以对抗肿瘤周围环境的免疫抑制,疫苗的一端是能够激活CAR-T细胞的抗原,另一端则是一条由脂类分子组成的长长的“尾巴”。在脂质尾的帮助下,这种疫苗能够与血液中的白蛋白(albumin)结合,使疫苗能够直接搭便车到淋巴结。
研究人员在不同类型肿瘤的小鼠模型中进行了实验,最终在胶质母细胞瘤、乳腺癌、以及黑色素瘤中观察到:抗癌疫苗与CAR-T疗法的组合,能在60%的小鼠中清除肿瘤。快速扩增的大量CAR-T细胞就好像一支浩浩荡荡的抗癌大军,在许多小鼠体内将肿瘤“清除得干干净净”。
疫苗的作用不仅在于它的免疫力,也在于它的有效时间,在两个多月后,研究人员重新将相同的癌细胞注射到小鼠体内,观察小鼠是否会对此作出反应。喜出望外的是,这些癌细胞很快被免疫系统清除,又过50天,效果依旧!
绝杀实体瘤,延长小鼠生存时间!
美国拉霍亚免疫学研究所的科学家发现,在CAR-T细胞中去除NR4A家族,获得了更好的治疗效果,大幅延长荷瘤小鼠的生存时间。
研究人员将制备好的CAR-T细胞进行了基因改造,敲掉Nr4a基因表达的CAR-T细胞和表达Nr4a基因的CAR-T细胞分别注射进入2组小鼠体内,以观察其抗肿瘤效果。结果发现:不表达Nr4a基因的CAR-T细胞治疗的患癌小鼠,大多数都存活了下来,并且即使是在治疗后90天的时间内,小鼠体内的肿瘤依旧被遏制并且在不断的缩小。而利用表达Nr4a转录因子的正常CAR-T细胞治疗的小鼠,大多数都在35天左右死亡。
不仅如此,敲除CAR-T细胞中的Nr4a转录因子也会阻断抑制剂受体TIM3和PD-1,而它们本身就是抗肿瘤免疫治疗的靶点。
这一系列的研究虽然都在小鼠中,但结果依旧令人惊叹,期待这些成果能够经过重重检验,早日应用到临床中,使更多癌症患者受益。(转化医学网360zhyx.com)
参考来源:
http://www.sohu.com/a/156750399_132582
http://news.sciencenet.cn/htmlnews/2019/8/429782.shtm
http://DOI: 10.1038/s41587-019-0192-1
Leyuan Ma et al. Enhanced CAR–T cell activity against solid tumors by vaccine boosting through the chimeric receptor.
Joyce Chen et al. NR4A transcription factors limit CAR T cell function in solid tumours.

 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发