乳腺癌如何转移?这些研究提供新思路
| 导读 | 乳腺癌一直是世界女性之痛,我国最新癌症数据统计显示,乳腺癌是我国女性发病率最高的肿瘤,可以说是名副其实的红颜杀手。转移是乳腺癌的致死性进展,一旦发生即可严重降低患者生存率并对患者预后产生恶性影响。 |

乳腺癌一直是世界女性之痛,我国最新癌症数据统计显示,乳腺癌是我国女性发病率最高的肿瘤,可以说是名副其实的红颜杀手。转移是乳腺癌的致死性进展,一旦发生即可严重降低患者生存率并对患者预后产生恶性影响。
乳腺肿瘤转移的过程存在许多不同的阶段,包括癌细胞侵入健康的乳房组织,逃离原发肿瘤,进入血管并在血管中存活,再进入新器官,然后在远处器官中存活并播种、形成新肿瘤,例如肺转移脑转移等。关于乳腺癌转移的探索,研究者们可谓绞尽脑汁,近期乳腺癌转移相关研究为大家整理如下。
激酶BRK“策划”乳腺癌转移

目前,尽管乳腺癌发生发展的分子机制尚未详尽得知,但细胞信号传导通路的异常激活应与其密切相关。Stowers医学研究所的研究人员发现了乳腺肿瘤激酶(BRK)对SMAD4的抑制作用,同时明确该通路激活是导致乳腺癌转移的关键因素。这项研究提出了乳腺癌治疗的一种潜在新靶点,表明靶向活化BRK信号传导和促进SMAD4表达的联合疗法可能对SMAD4抑制的乳腺癌有益,这就为乳腺癌治疗提供了一条新思路。

PYGB帮助乳腺癌细胞“吃饱”并转移
自上个世纪70年代“waburg效应”被提出以来,越来越多的科学家开始围绕着能量代谢来对癌症展开研究。但癌细胞如何储存糖原、以及糖原的分解代谢是如何影响癌症发展,这背后的机制依然不得而知。在乳腺癌中,肿瘤乏氧与预后不良和侵袭性增强增加有关。缺氧激活癌细胞的转录程序,导致其更快速地生长、转移。那么,缺氧与糖原储存是否具有相关性呢?
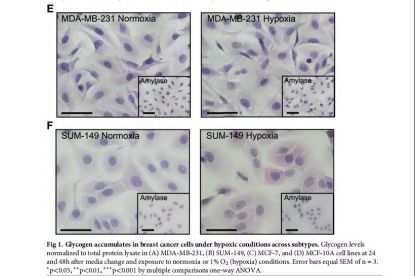
不同亚型缺氧条件下乳腺癌细胞糖原蓄积
不久前,来自密歇根大学癌症研究中心的研究人员发表的一篇论文中提到,乳腺癌细胞储存能量,利用能量代谢来促进自身生长、扩散和转移,控制脑内糖原降解的酶--糖原磷酸化酶B(PYGB)在乳腺癌糖原控制中起着关键作用。当研究人员靶向去除PYGB时,三阴乳腺癌、炎性乳腺癌、激素受体阳性乳腺癌细胞无法利用糖原进行能量储存,这意味着乳腺癌细胞进一步的发生发展受到了限制。但他们在正常的乳腺细胞中并没有看到同样的效果,因此,乳腺癌细胞特异性利用糖原分解储存能量来供应自身的营养。总之,该研究表明,PYGB可能是治疗或预防乳腺癌转移新的潜在靶点。
E-钙粘蛋白抑癌&促癌“两不误”
此外,Nature上发表的一项研究中,美国约翰霍普金斯大学的研究人员发现常见细胞“粘合剂”——E-钙粘蛋白(E-cad)对乳腺癌转移“功不可没”。他们指出在乳腺侵袭性导管癌中,E-cad可限制癌细胞内的分子应力,使细胞在转移后继续存活并形成新的肿瘤。而E-cad却是公认的可以限制肿瘤转移的分子。研究表明,在乳腺侵袭性导管癌中E-cad是一把双刃剑,当其需要转移时,E-cad的表达会受限,但并未完全消失,从而赋予癌细胞侵袭能力。在“解放”癌细胞后,E-cad又化身为癌细胞的“守护神”促进其转移。这提示若能进一步掌握E-cad作用的时相,在相应的时间内控制E-cad的功能,也许能为转移性乳腺癌患者带来一线生机。

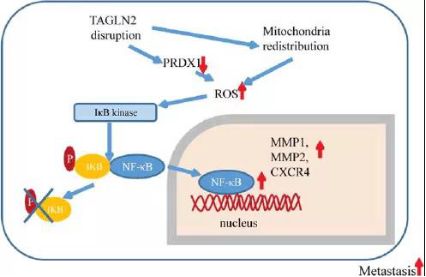
乳腺癌转移抑制因子:TAGLN2
转凝蛋白2是由TAGLN2基因编码的钙调理蛋白家族细胞骨架蛋白,异常表达于各种类型的癌症。既往研究发现,淋巴结阳性乳腺癌患者的TAGLN2表达水平显著较低,然而TAGLN2对于乳腺癌转移的作用尚不明确。复旦大学附属肿瘤医院研究者发现,TAGLN2低表达可以激活氧自由基 → 细胞核因子κB信号转导通路,从而促进乳腺癌转移,TAGLN2可以作为一种新的肿瘤抑制因子。
乳腺癌细胞竟伪装成神经细胞野蛮生长
在 HER-2 阳性转移性乳腺癌患者中,颅脑转移的发病率高达30%-55%,其总生存期仅仅13个月。乳腺癌脑转移如此可怕,其背后的机制却至今未解。另一篇Nature上发表的文章中,瑞士癌症中心联合美国华盛顿国家儿童医学中心及英国剑桥大学的研究报告,发现乳腺癌细胞竟“伪装”成神经细胞,不断促进自身生长。

在乳腺癌脑转移的研究中,NMDAR(N-甲基-D-天冬氨酸受体谷氨酸配体)信号受到了最多的关注。研究人员发现,一些癌细胞分泌大量谷氨酸来激活NMDAR,而人类和小鼠的乳腺癌脑转移细胞表达受体分泌的谷氨酸不足,它们通过伪装来迷惑机体的免疫系统,通过与谷氨酸能神经元之间形成假三联突触以诱发信号转导。在这种情况下,乳腺癌利用机体的信号通路,诱发NMDA信号转导,促进脑转移,共同加快了乳腺癌的生长速度和致死速度。
电磁场阻止乳腺癌转移
发表在nature communications biology上的一项研究表明,低强度电磁场通过抑制EGFR(表皮生长因子受体)激活,阻止富含肌动蛋白的丝状伪足的形成,并阻碍乳腺癌细胞的运动。

研究人员在实验中,将均匀的电磁能量应用于不同类型的乳腺癌细胞,发现转移性三阴性乳腺癌细胞对激素疗法或针对乳腺癌常见表达基因的靶向治疗无效,但是对电磁场最敏感。这项研究表明,电磁场可能有助于防止乳腺癌的扩散和转移,有望突破针对这种难治性疾病的已知瓶颈。
p53缺失促进乳腺癌转移的机制
荷兰癌症研究所的研究团队发现,p53的状态对于乳腺癌细胞中系统性炎症有着非常重要的驱动作用,靶向WNT信号通路可能为p53缺陷型乳腺癌提供治疗思路。对癌细胞内在遗传信息和免疫信号通路之间错综复杂的相互作用的机制理解,为癌症患者的个性化免疫干预策略的设计提供了分子机制的基础。

这项研究将癌细胞中p53的缺失、WNT配体的分泌以及系统性中性粒细胞的增多与癌症细胞转移相联系,为乳腺癌等癌症提供了新的治疗思路。
参考文献
1. Megan A. AltemusID Laura E. Goo Breast cancers utilize hypoxic glycogen stores via PYGB, the brain isoform of glycogen phosphorylase, to promote metastatic phenotypes
2. https://mp.weixin.qq.com/s/PmJdmKIWakV3HUtLFUA3qg
3. S. Miah,et al.BRK phosphorylates SMAD4 for proteasomal degradation and inhibits tumor suppressor FRK to control SNAIL, SLUG, and metastatic potential.Science Advances 23 Oct 2019.
4. Veena Padmanaban, et al.E-cadherin is required for metastasis in multiple models of breast cancer.Nature (2019).
5. Qiqun Zeng, Iacovos P. Michael, Synaptic proximity enables NMDARsignalling to promote brain metastasis, Nature
6. Downregulation of transgelin 2 promotes breast cancer metastasis by activating the reactive oxygen species/nuclear factor-κB signaling pathway.
7.Electromagnetic fields alter the motility of metastatic breast cancer cells
8.Loss of p53 triggers WNT-dependent systemic inflammation to drive breast cancer metastasis
推荐阅读:
-
日程更新:108位重量级嘉宾等你来!第三届现代临床分子诊断论坛&第四届精准医学高峰论坛
-
强强联手!新组合用药有望“创造”靶点,实现对癌症“围追堵截”
-
这些被忽视的免疫细胞,竟是乳腺癌细胞治疗的“潜力股”!
-
Science子刊:深挖“双面蛋白”沦为肿瘤免疫逃逸帮凶的真相
-
Cancer Cell:基于多蛋白复合物的癌症精准治疗范式,有望攻克一半以上的肿瘤
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发