新视角! PD-L1+ CTEC及CTC在肺癌NSCLC中的不同重要临床意义
| 导读 | 免疫治疗近年来已成为肿瘤治疗的重要手段,然而目前只有30%的肺癌病人治疗效果显著(ASCO2019)。因此,有效检测并揭示对免疫治疗耐药的相关细胞具有非常迫切的重要意义。 |
免疫治疗近年来已成为肿瘤治疗的重要手段, 然而目前只有30% 的肺癌病人治疗效果显著(ASCO 2019)。因此,有效检测并揭示对免疫治疗耐药的相关细胞具有非常迫切的重要意义。当人们的目光还在聚焦于CTC的同时,“细胞型循环肿瘤标志物”的另一重要组成部分 — “异倍体循环肿瘤血管内皮细胞CTEC”已开始进入人们的视野。
最近,首都医科大学附属北京胸科医院、北京大学肿瘤中心/北京肿瘤医院消化道肿瘤内科重点实验室及赛特生物密切合作,应用赛特SE-i·FISH® 技术对接受二线O 药(opdivo, nivolumab)免疫治疗的晚期非小细胞肺癌(NSCLC)患者体内PD-L1+ CTC及CTEC进行了联合检测与深入研究。本研究在国际上首次报道了外周血中PD-L1+ 异倍体CTEC 的存在,并发现PD-L1+ CTEC对免疫治疗具有耐药特性,且与患者的PFS密切相关。相关成果刚刚发表在《Cancer Letters 》杂志 (影响因子 IF=6.508)。文章第一作者为北京胸科医院张丽娜、张新勇,通讯作者为赛特生物林平博士,北京胸科医院李伟英主任为共同通讯作者。

本文要点
* 应用SE-i·FISH® ,在治疗前44%组织标本hPD-L1- 的NSCLC患者体内,可有效检测出PD-L1+ CTC
* CTC及CTEC在免疫治疗后会发生蛋白表型、细胞形态、及染色体核型的转换(post-therapeutic karyotype shifting),形成对治疗耐药的不同亚类细胞
* 与CTC不同,PD患者的CTEC总数及PD-L1+ CTEC亚类细胞数目显著增加
* PD-L1+ CTEC 具有对免疫治疗O药耐药特性。其中,多倍体(≥4 倍体) PD-L1+ CTEC具有“内源性耐药”特性,而三倍体PD-L1+ CTEC则呈现“诱发性耐药”特性
* 含有8号染色体多倍体PD-L1+ CTEC的NSCLC PD患者,无进展生存期 (PFS) 明显缩短
* 本实验对研究肿瘤免疫治疗耐药具有重要意义
肿瘤微环境
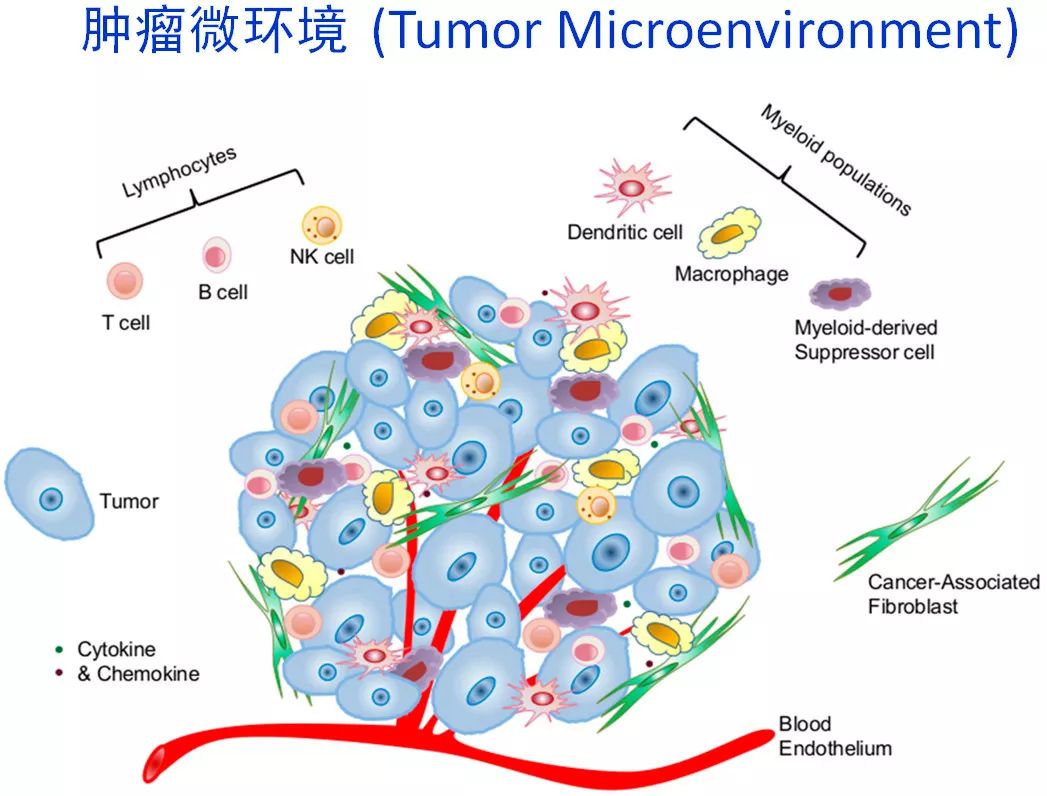
肿瘤细胞、异倍体肿瘤血管内皮细胞(tumor endothelial cell, TEC)及免疫淋巴细胞是“肿瘤微环境”的重要组成成分。肿瘤微环境中,肿瘤血管内皮细胞TEC增生,可阻碍血液中的淋巴细胞自血液外渗出血管并向肿瘤输送,进而影响对肿瘤细胞的杀伤作用;而肿瘤细胞又可通过其PD-L1分子与T淋巴细胞上的PD-1 相结合,从而封闭淋巴细胞对肿瘤的杀伤功能。现已证实,部分TEC可脱落入血,形成“异倍体循环肿瘤血管内皮细胞CTEC” (Lin et al., 2017 Sci Rep 7:9789),其数量变化可反映肿瘤血管的增生情况。
肿瘤联合治疗过程中同步检测CTC与CTEC
抗血管生成是临床治疗肿瘤的主要手段之一,然而单纯抗血管生成治疗可诱导肿瘤细胞高表达PD-L1,进而抑制淋巴细胞对肿瘤细胞的杀伤作用(Campesato et al., 2017 Ann Transl Med 5:497)。联合使用抗血管生成与抗PD-1或抗PD-L1治疗,有可能会获得更佳的治疗效果。这一点最近已在乳腺癌及胰腺癌肿瘤动物模型上得到了证实(Allen et al., 2017 Sci Transl Med 9:385)。
将肿瘤微环境中的肿瘤细胞 、TEC及免疫淋巴细胞三者统筹兼顾的联合治疗(肿瘤免疫治疗+抗血管生成)已成为肿瘤治疗的重要手段。然而肿瘤的高度异质性造成了联合治疗的效果会因瘤种不同及患者个体不同而有很大差异。因此精准治疗显得尤为重要,而精准治疗的首要前提是必须具备“个体化精准检测”的有效实验手段。如何同时评估免疫治疗和抗血管生成药物的疗效是目前困扰临床的最大问题。因缺乏相关检测技术手段,迄今为止国内外没有任何相关研究报道。本课题应用SE-i·FISH®技术同步联合检测PD-L1+ CTC与CTEC,并在分子水平探究其对免疫治疗敏感和耐药特性,取得的重要成果在国际上填补了此领域的空白。
为了准确筛选适于免疫治疗的肿瘤患者、有效制定个体化治疗方案、以及全面客观评估肿瘤免疫治疗或联合其它治疗手段的疗效 (包括放化疗、靶向、介入、抗血管生成等),相关液体活检已不应该再局限于以往单一的PD-L1+ CTC检测,而是将PD-L1+ CTC与PD-L1+ CTEC 进行联合检测与综合考量,这将为人们在肿瘤防治及研究等领域提供全新的视角以及更加完整、客观的实时性检测结果。
6-通道SE-i·FISH® 同步原位检测Vimentin+ 及PD-L1+ CTCs 与CTECs
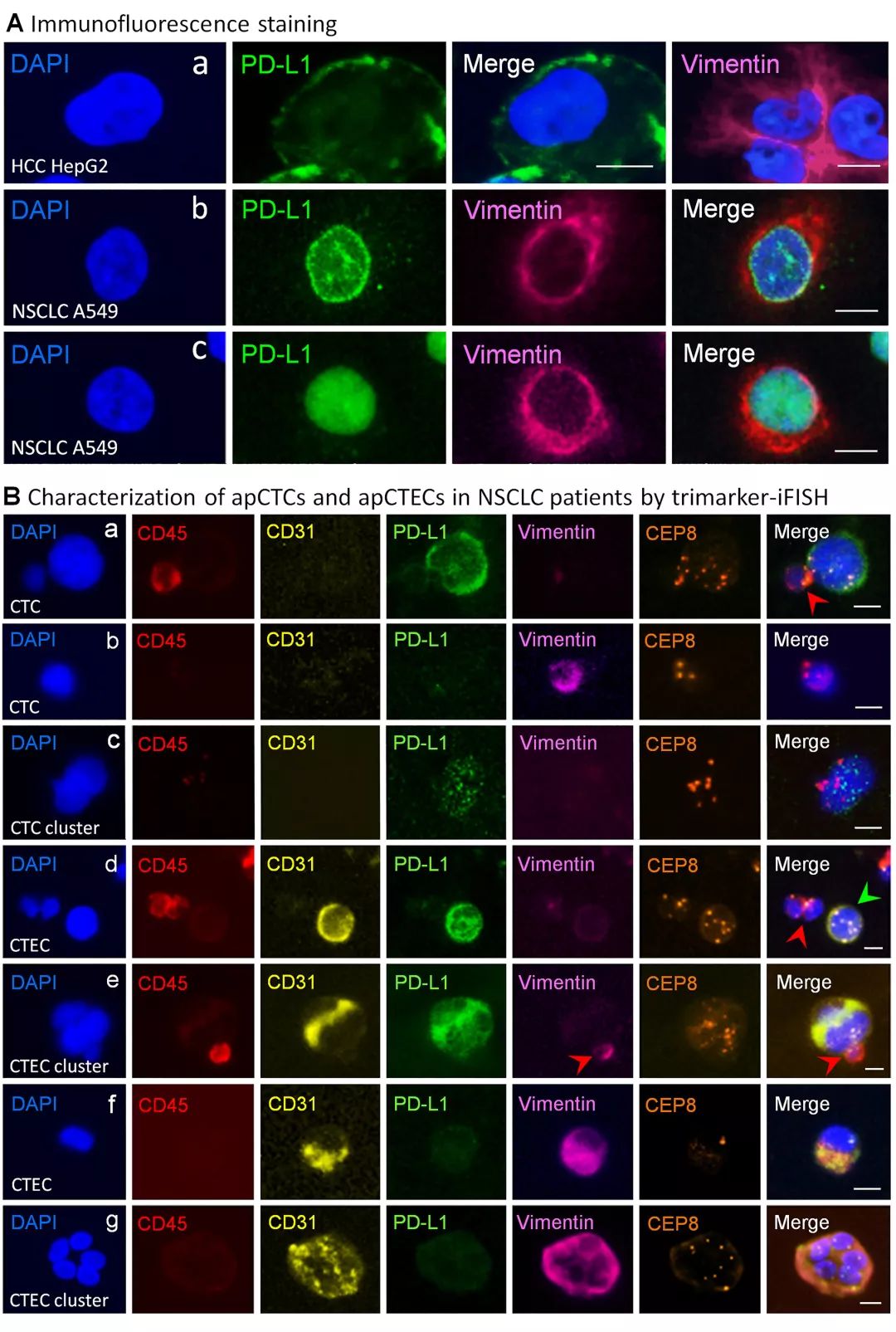
与PD-L1分布在HepG2肝癌细胞膜表面不同,NSCLC肺癌细胞A549中的PD-L1主要表达在细胞核内或核膜上 (nuclear nPD-L1)。细胞内不同部位的PD-L1具有不同的生物学功能与临床意义,例如,NSCLC肿瘤细胞上的PD-L1表达与肿瘤细胞的间质化表型(Vimentin+) 密切相关 (Kowantez et al., 2018 PNAS 115:E10119),PD-L1向核内的转运与Vimentin的表达及PI3K/AKT信号传导通路相关。nPD-L1+ 的结直肠癌及前列腺癌患者,其PFS及OS明显缩短 (Satelli, et al., 2016 Sci Rep 6:28910)。
临床实验数据分析 :多倍体PD-L1+ CTEC亚类细胞具有对免疫治疗耐药的特性
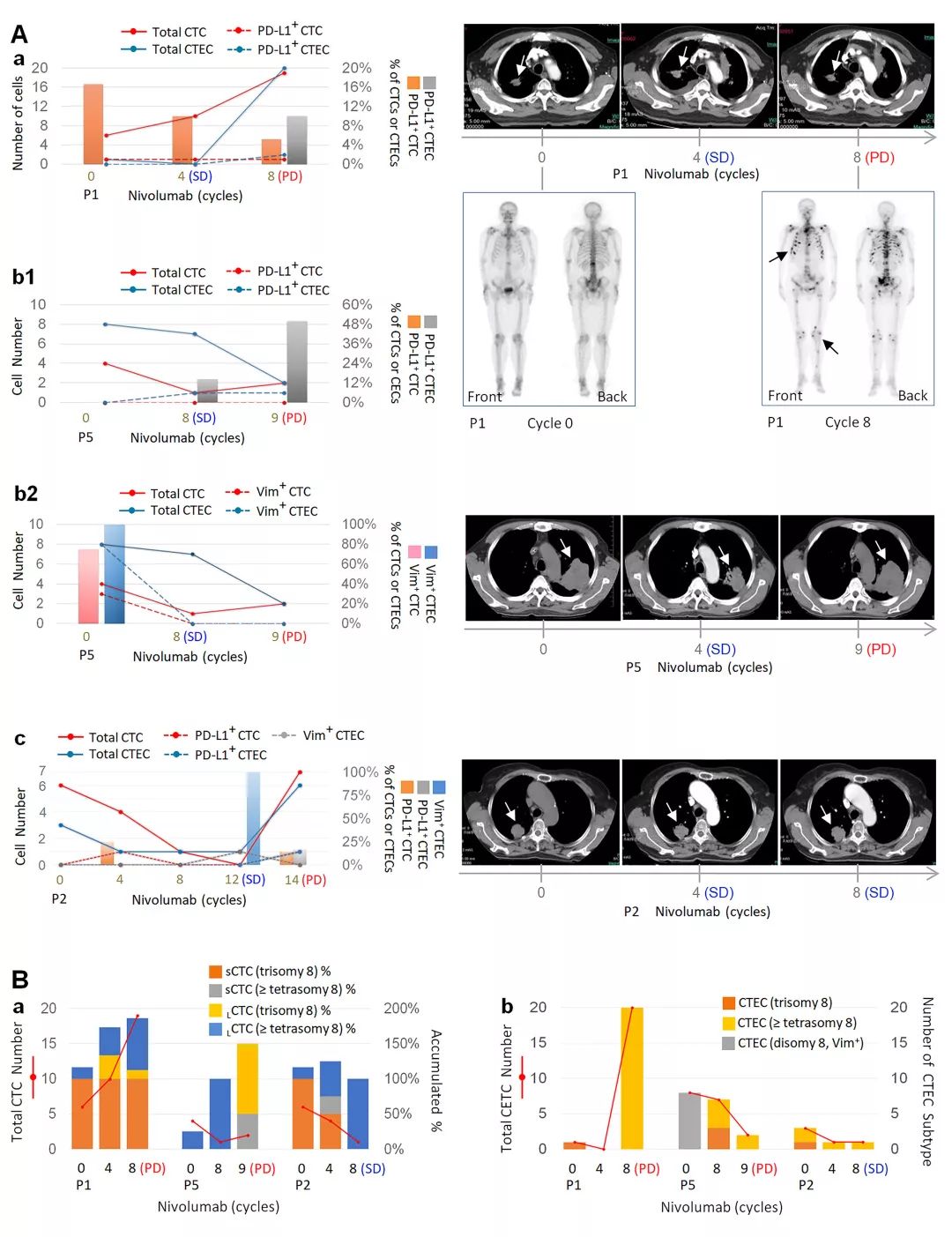
动态监测CTC、CTEC案例报道:1)患者P1 接受O药治疗至第8疗程时进展为PD,并伴有肺癌远端骨转移。此时,多倍体大细胞CTC及CTEC 数目均有很大增加,且PD-L1+ CTEC的比例增加;2)患者P5治疗至第9个疗程时呈现PD,原发灶显著增大,但无远端转移。患者CTEC数目降低,Vim+CTC及CTEC消失,PD-L1+ CTC消失,但PD-L1+ CTEC的比例显著增高,患者在从第8程至第9程发生PD的过程中,大细胞CTC数目增多;3)患者P2治疗至第12疗程时仍为SD,可见CTC及CTEC数目降低,PD-L1+ CTC消失,但仍检测出Vim+ CTEC,14疗程时患者呈现PD,此时CTC及CTEC总数增加,并伴有PD-L1+ CTEC 及PD-L1+ CTC 出现。
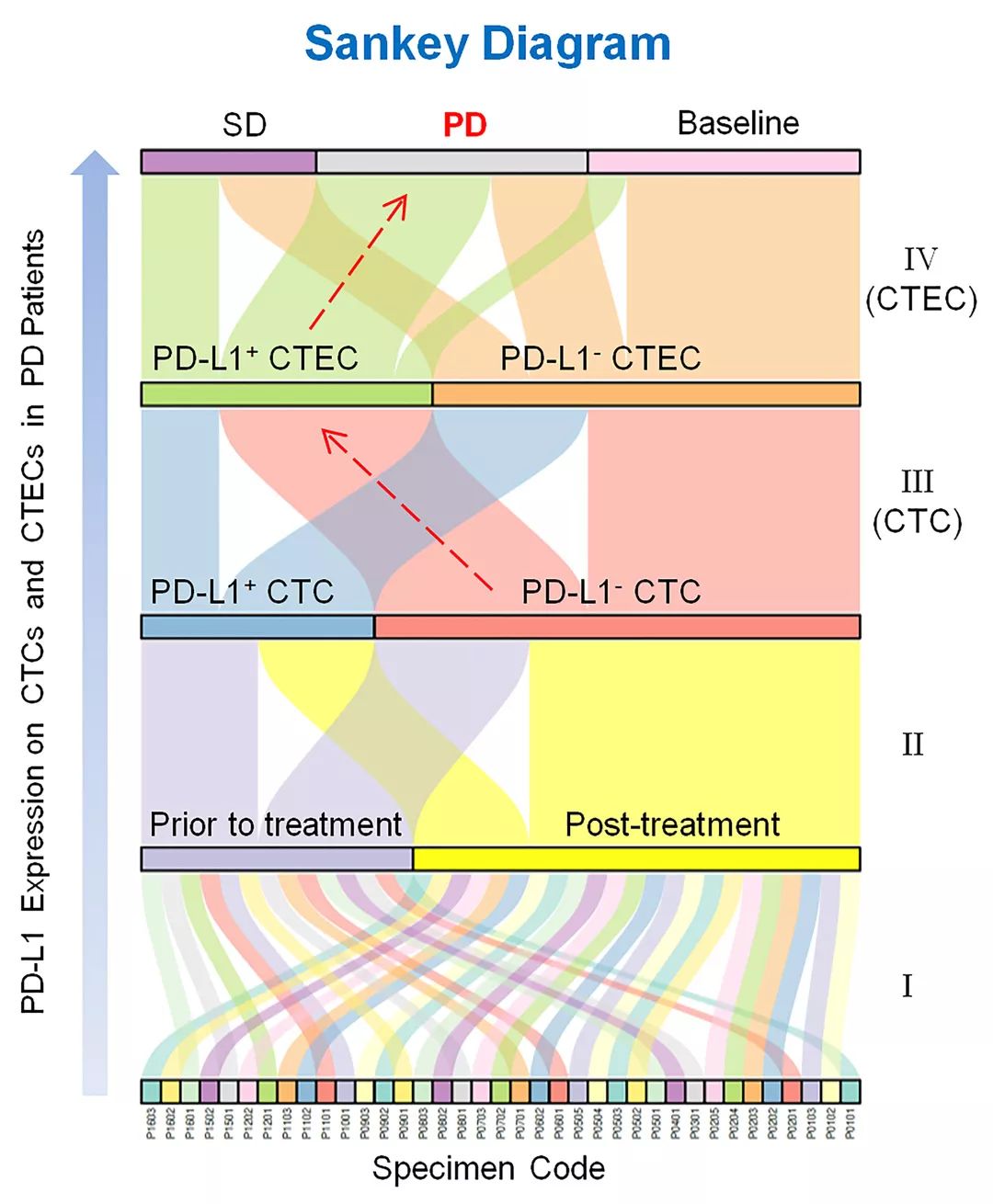
群体临床数据分析发现,二线O药治疗后的PD 病人,CTEC总数显著上升。“治疗后核型转换”分析(post-therapeutic karyotype shifting)显示,免疫治疗后进展为PD的患者体内8号染色体多倍体(≥4倍体)大细胞 CTEC比例高达81%,较治疗前增加了近一倍。通过桑基图 (Sankey Diagram) “细胞流向分布”可见,PD患者体内增加的CTEC主要是PD-L1+ CTEC亚类细胞,而这些患者的CTC通常呈现PD-L1- 。
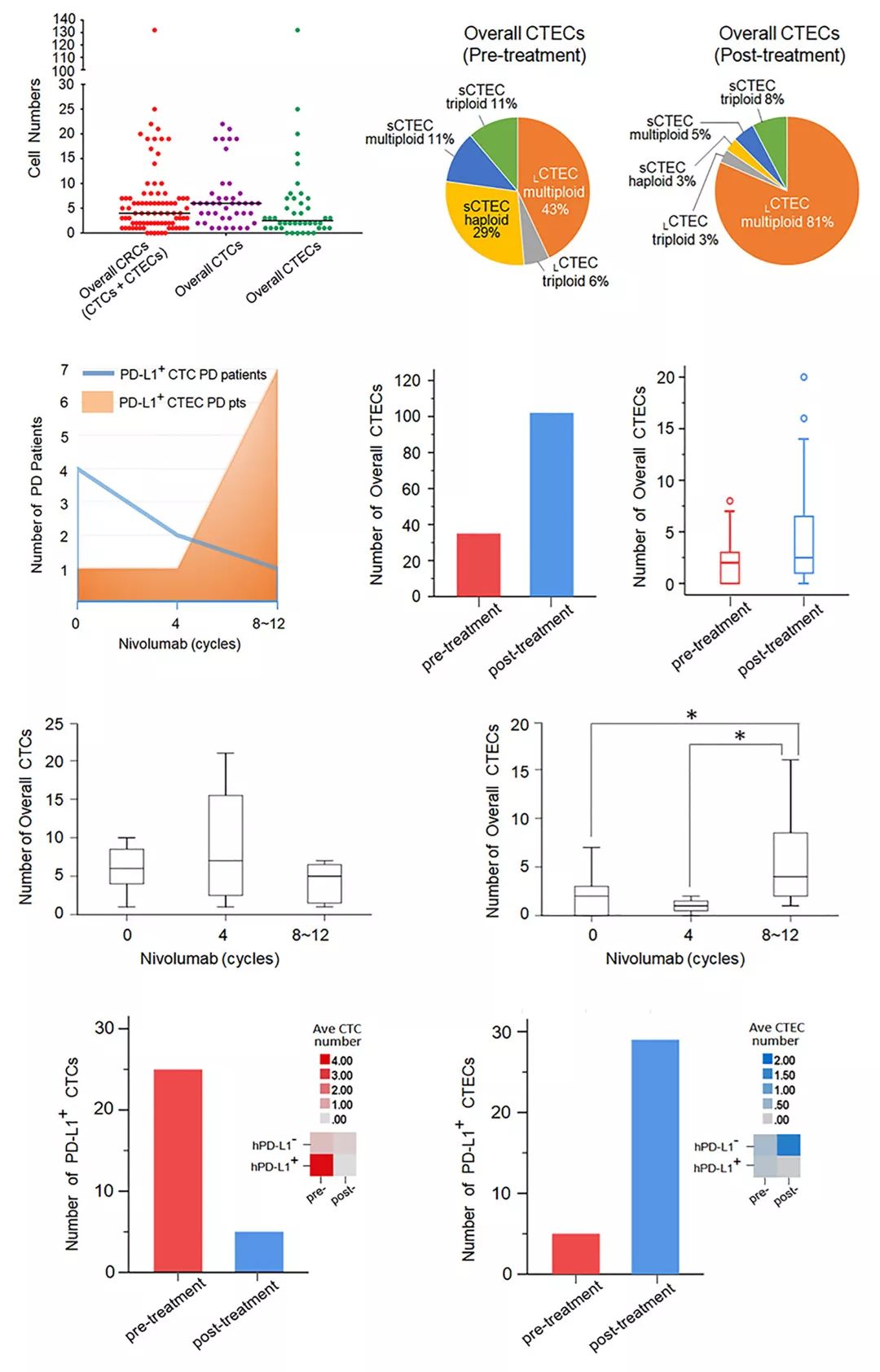
免疫治疗后的PD患者中,虽然PD-L1+ CTC仍然可以得到有效控制,由治疗前的PD-L1+ CTC 4人降低为PD时的1人,但检测出PD-L1+ CTEC的患者则由疗前1人增加为PD时的7人。热图分析显示,PD-L1+ CTC主要见于治疗前hPD-L1+ 患者,而PD-L1+ CTEC则主要在hPD-L1- 患者接受O药治疗后出现。
PD患者体内出现的PD-L1+ CTEC,主要由治疗前就已存在的多倍体大细胞CTEC (69%) 和免疫治疗后才出现的三倍体CTEC (31%)组成。因此,PD-L1+ 多倍体CTEC 具有“内源性免疫治疗耐药”特性,而PD-L1+ 三倍体CTEC具有“诱发性免疫治疗耐药”特性。由此可见,二线免疫治疗引起PD-L1+ CTEC的“治疗后核型转换”与肿瘤产生诱发性免疫治疗耐药相关。
PD-L1+ CTEC 与PFS密切相关
肿瘤进展后的PD患者体内无论是否含有PD-L1+ CTC,其PFS无显著性差异;但含有PD-L1+ CTEC的患者,其PFS显著缩短。由此可见,多倍体PD-L1+ CTEC与肿瘤进展密切相关。
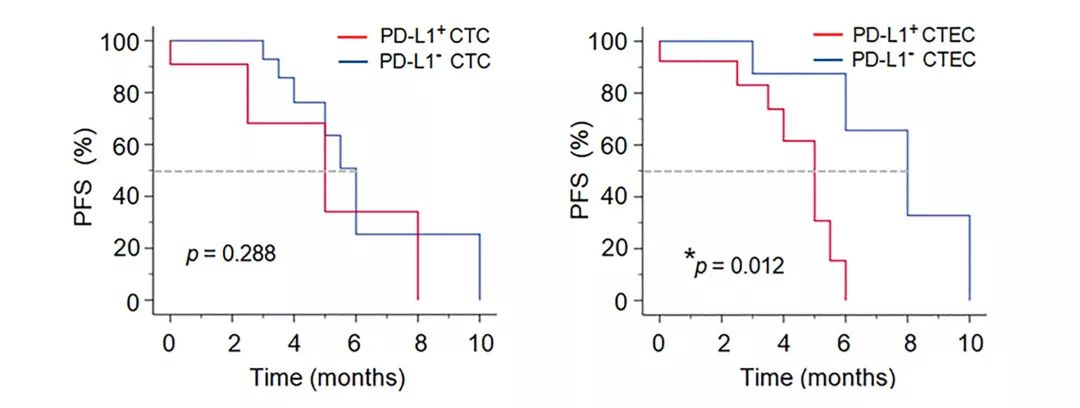
CTEC 检测的特殊临床意义
本研究发现,PD的肿瘤患者伴有CTEC总数和PD-L1+ CTEC 亚类数目的增加,患者此时的肿瘤血管内皮TEC增生,阻碍血液中的淋巴细胞外渗出血管向肿瘤输送;同时TEC及CTEC上的PD-L1又可与T淋巴细胞上的PD-1相结合 ,从而进一步抑制淋巴细胞对肿瘤细胞的免疫杀伤作用。而PD-L1+ CTC数量在患者PD时并无升高,提示PD-L1+ CTEC 与PD-L1+ CTC对anti-PD-1免疫治疗具有不同的应答机理与疗效。二线O 药可能无法有效阻断T淋巴细胞上的PD-1 与CTEC上的PD-L1相结合,或无法促进T 细胞消除PD-L1+ CTEC,从而最终导致肿瘤进展 (PD)。
CTC与CTEC两者间不仅能够相互协调,而且可以相互融合,形成异倍体“肿瘤上皮-肿瘤血管内皮”融合细胞团。与EMT过程相似,此融合细胞团可通过EndoMT表现为Vimentin+ 间质型 (Lin et al., 2017 Sci Rep 7:9789),或是本文报道的Vim- 非间质型。
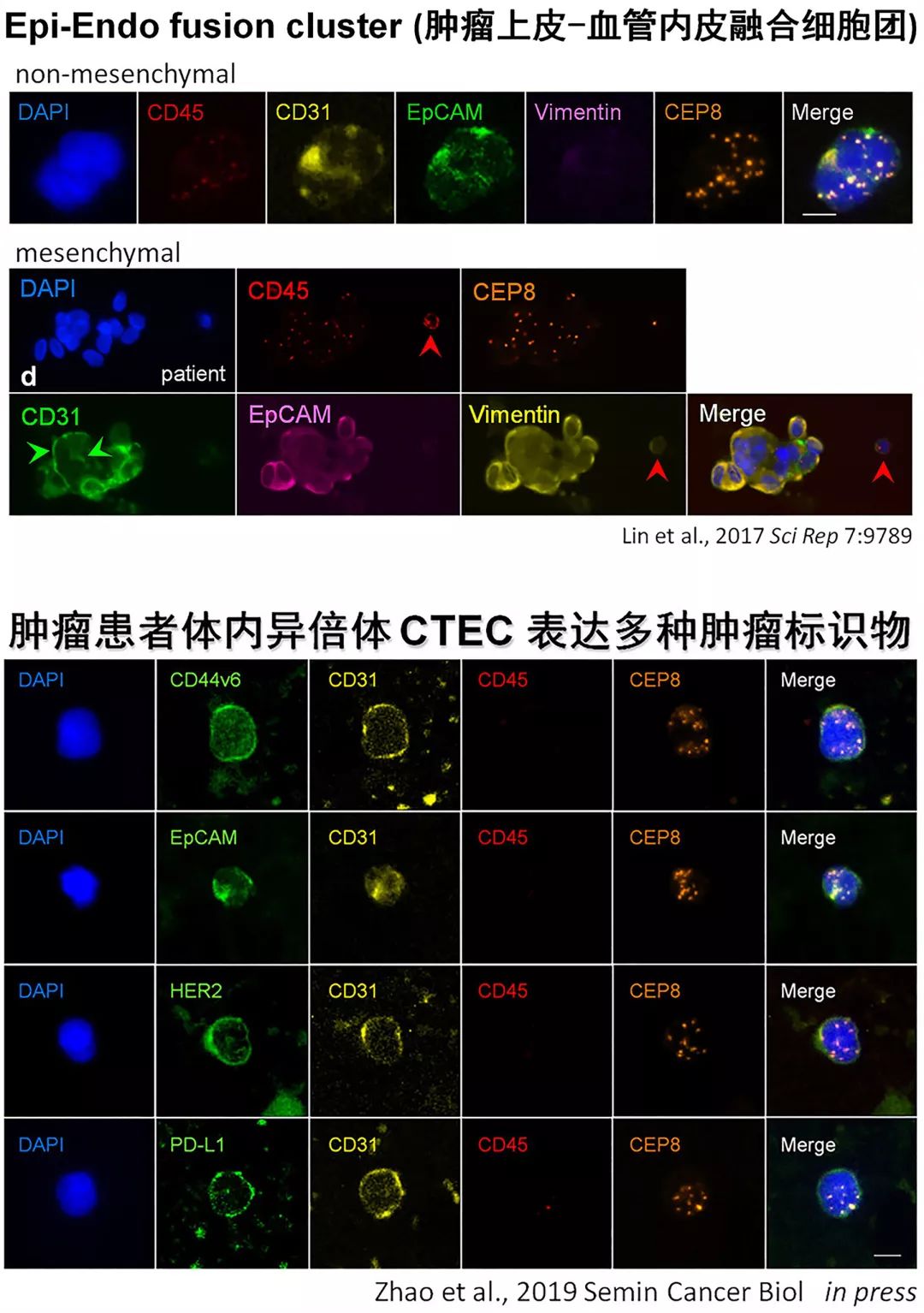
除了PD-L1、Vimentin以外,我们已证实异倍体CTEC还可表达其它多种肿瘤标志物,如HER2, EpCAM 及干细胞标志物 CD44v6 等。深入开展后续相关研究,将有助于人们进一步阐明“细胞型循环肿瘤标志物”CTC与CTEC (尤其是那些表达了肿瘤标志物的CTEC、融合细胞团等) 是如何在肿瘤寡转移和远端广泛转移过程中相互协调并发挥重要作用的 (Zhao et al., 2019 Semin Cancer Biol, in press)。此外,国际上已有报道指出,异倍体染色体数目的多少与肿瘤的恶性度成正比。染色体异常拷贝数越高,肿瘤恶性度越高 (Kronenwett et al., 2004 Cancer Res 64:904)。CTC及CTEC中的染色体异常拷贝数与肿瘤进展、耐药、转移、复发等的关联性显然也是今后值得密切关注的新领域。
结 论
* 本实验建立了如何利用SE-i·FISH® 同步、原位联合检测PD-L1+ CTEC与CTC的完整实验体系与思路(包括实验设计、数据采集、从个例到群体的结果分析方法、相关临床意义的探讨等),为今后开展不同瘤种的大规模临床实验奠定了基础
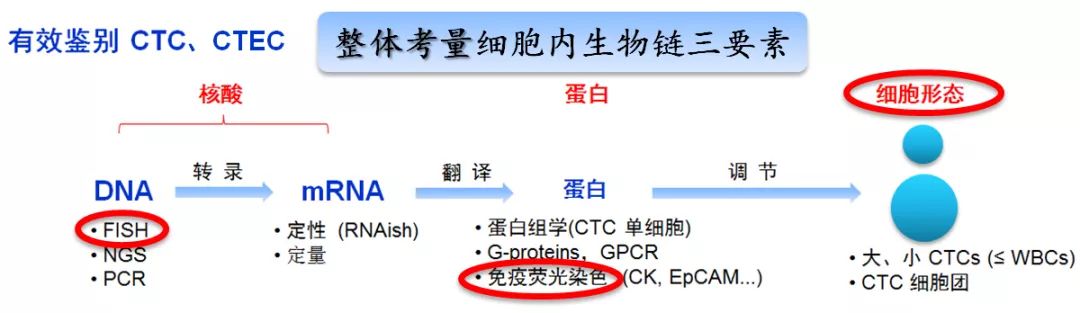
* 针对CTC及CTEC的不同临床意义,本研究已不再局限于单一的细胞计数,而是围绕细胞生物链三要素 (肿瘤标志物蛋白表型、染色体核型及细胞形态) 在分子水平上开展三位一体的全方位综合性检测CTC与CTEC (Lin 2018 Diagnostics (Basel) 8:26),从而为广大医生提供更加全面、准确、客观的肿瘤治疗全程实时信息
* PD-L1+ CTEC 与PD-L1+ CTC对anti-PD-1免疫治疗具有不同的应答机理与疗效
* 异倍体CTC 与CTEC共同构成了具有生物活性的、实时性“细胞型循环肿瘤标志物”,具有伴随肿瘤进展的完整核酸与蛋白信息含量,两类细胞相辅相成、相互作用,在肿瘤的发生、进展、转移、耐药、复发等过程中发挥着关键作用
* 动态联合监测异倍体PD-L1+ CTC及PD-L1+ CTEC 可实时评估单一治疗或联合治疗肿瘤的疗效,并能锁定对治疗敏感或耐药的不同CTC 或CTEC亚类细胞,从而为筛选适于接受免疫治疗的肿瘤患者、制定个体化精准治疗方案、提高肿瘤治疗疗效以及开展后续单细胞分析、抗肿瘤新药研发等提供积极指导意义
原文链接:
https://doi.org/10.1016/j.canlet.2019.10.041

(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发