【PNAS】中南大学陶永光教授团队揭示可作为潜在诱导肿瘤细胞铁死亡的最新靶标
| 导读 | 铁死亡是一种铁依赖性氧化,非凋亡形式的调节细胞死亡,由氧化还原稳态的破坏引起。最近的研究揭示了调节铁死亡的复杂细胞网络。GINS4是真核G1 / Scell循环的启动子,作为DNA复制开始和伸长的调节剂,但对其对铁死亡的影响知之甚少。 |
4月5日,中南大学基础医学院肿瘤研究所陶永光团队在《Proceedings of the National Academy of Sciences of the United States of America》(PNAS)发表研究论文“GINS4 suppresses ferroptosis by antagonizing p53 acetylation with Snail”,研究发现GINS4参与了肺腺癌铁死亡的调控。该团队在研究探讨DNA复制基因在LUAD中的作用时,发现抑制GINS4的蛋白表达可有效促使G1、G1/S、S和G2/M期细胞发生铁死亡,其中处于G2/M期的细胞对铁死亡诱导剂Erastin的诱导表现最为敏感。

https://doi.org/10.1073/pnas.2219585120
研究背景
DNA复制是指DNA双链在细胞分裂以前进行的复制过程,从一个原始DNA分子产生两个相同DNA分子的生物学过程。错误的DNA复制事件可导致疾病。GINS复合物是一种异四聚体结构,由四个不同的亚基组成(人类基因组中称为GINS4, GINS1, GINS2和GINS3)。GINS4是GINS复合物的重要组成部分,在启动和延长DNA复制,促进真核细胞G1/S细胞周期中起着不可或缺的作用。
铁死亡是一种独特的具有铁依赖性的程序性细胞死亡形式,它有助于维持正常细胞和组织中的生存与死亡平衡, 并与疾病也别是癌症的发展有关,也是肿瘤治疗一个重要的切入点。然而,铁死亡与DNA复制的相关性仍有待研究。
研究进展
GINS4在非小细胞肺癌组织和细胞系中高表达。GINS4在其他人类肿瘤组织和细胞系中的过表达也有报道。生存分析显示,GINS4高表达的肿瘤患者(肺癌、胃癌、结直肠癌和胰腺癌)的总生存期和无病生存期显著低于GINS4低表达的肿瘤患者。因此,GINS4可能参与癌症的恶性进展,成为癌症治疗和诊断的潜在靶点。
在分子机制方面,p53、自噬、神经纤维瘤病2 - YAP ( NF2-YAP )、p62-Keap1-NRF2、谷氨酰胺分解代谢等信号通路主要参与铁死亡的调控。p53在人骨肉瘤细胞或小鼠胚胎成纤维细胞( MEFs )中诱导精脒/精胺乙酰基转移酶1 ( SAT1 )或谷氨酰胺酶2 ( GSL2 ) 在转录水平表达,通过调节脂质过氧化促进铁死亡。它还抑制胱氨酸/谷氨酸反向转运体溶质载体家族7成员11 ( SLC7A11 ;也称为xCT)的转录,促进GSH耗竭,诱导铁死亡,从而导致人骨肉瘤、乳腺癌或肺癌细胞的肿瘤抑制。小鼠p53 3KR突变K117、K161和K162 (在此后简称为p53 3KR / 3KR)减弱了其抑制癌症的能力。
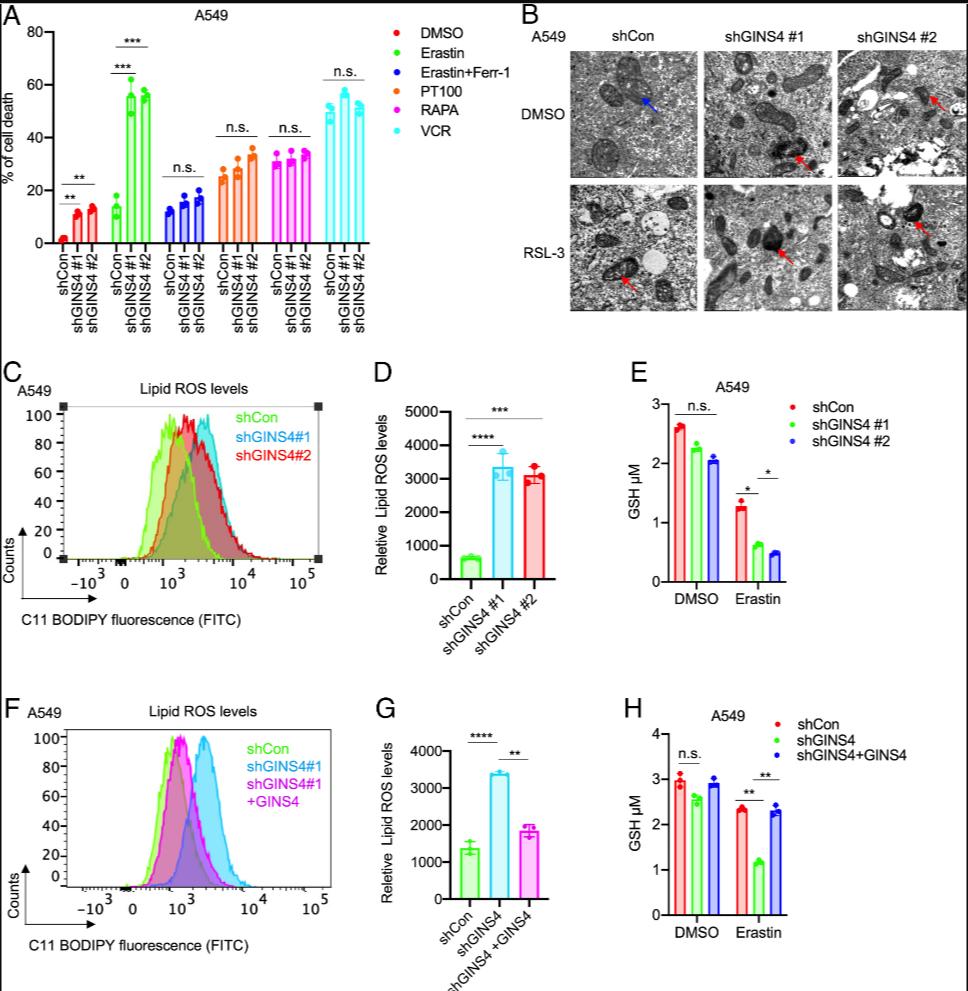
GINS4缺失促进体外铁死亡
Snail是EMT的关键分子,促进肿瘤细胞的侵袭和转移,赋予肿瘤细胞肿瘤干细胞样特性,促进药物和辐射抗性。Snail也是调节p53乙酰化的重要分子,因为它通过与p53和组蛋白去乙酰化酶( HDAC1 )结合引起p53 K382的去乙酰化。因此,在乳腺癌中,Snail降低p53活性并在p53依赖的抗凋亡和细胞命运中发挥作用。另一方面,p53激活靶向Snail的miRNA - 34,从而抑制Snail的活性。
研究结果

综上,该团队揭示此现象的分子机制为GINS4通过上调Snail的蛋白表达,拮抗p53的蛋白乙酰化,并且人来源的p53赖氨酸残基351是GINS4抑制p53介导的铁死亡的关键位点,上述结果表明GINS4可能是LUAD中铁死亡的重要新型调节因子。该研究提示,GINS4在LUAD中是一个潜在的致癌基因,通过破坏抑癌基因p53的蛋白稳定性,抑制铁死亡。该蛋白可能成为LUAD的一个潜在的治疗靶点(转化医学网360zhyx.com)。
参考资料:
https://news.csu.edu.cn/info/1004/155446.htm
https://doi.org/10.1073/pnas.2219585120
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录

还没有人评论,赶快抢个沙发