第二篇!西湖大学施一公团队合作再取进展
| 导读 | U2 小核核糖核蛋白 (snRNP) 对前 mRNA 分支位点 (BS) 的选择对前剪接体(A 复合物)组装至关重要。RNA 解旋酶 PRP5 验证了 BS 选择,但其潜在机制尚不清楚。 |
2024年1月9日,西湖大学施一公团队在 Nature 子刊《Nature Structural & Molecular Biology》 发表了题为“Structural Insights into Branch Site Proofreading by Human Spliceosome”的最新研究论文。研究报道了人源17S U2 snRNP复合物和剪接体pre-A复合物的高分辨率结构,并结合生化和功能实验,揭示了剪接体进行分支位点选择、校正的分子机制。

https://www-nature-com-443.vpnm.ccmu.edu.cn/articles/s41594-023-01188-0
研究背景
01
Pre-mRNA的剪接由剪接体执行,这是一种动态的超分子机器。剪接体通过识别内含子的保守元件:5 ' -剪接位点(5 'SS)、BS、聚嘧啶束(PPT)和3 ' -剪接位点(3 'SS),组装在pre-mRNA上。首先,U1 snRNP、SF1、U2AF2和U2AF1分别识别5'SS、BS、PPT和3'SS,形成E complex。然后,U2 snRNP取代SF1,使U2 snRNA与BS之间形成双工,从而形成A complex。在高等真核生物中,大多数基因通过选择不同的剪接位点进行选择性剪接。因此,选择BS的A complex的形成是剪接调节的焦点。可惜的是,人们对E-to-A转换背后的步骤知之甚少。
RNA解旋酶PRP5(也称为DDX46)在A complex的组装过程中起关键作用。在人类17S U2 snRNP中,U2 snRNA无法与BS配对,因为U2 snRNA的相关序列形成双链BSL。ATP被PRP5水解导致BSL解绕,从而促进U2-BS双相的形成。在酵母中,Prp5可能校对U2-BS双工,因为Prp5突变允许使用隐性BS和3'SS。然而,PRP5调控剪接保真度的机制尚不清楚。
研究结果
02
我们首先通过PRP5上引入的Flag标签纯化出内源的17S U2 snRNP并解析了整体分辨率达到2.5 Å的电镜结构。随后通过使用exon-definition的pre-mRNA底物和小分子抑制剂spliceostatin A(SSA),成功组装并捕获了一个介于E和A complex中间的反应状态,命名为pre-A复合物。Pre-A复合物主要包含两个区域:U2 snRNP区域和U1 snRNP区域。其中U1 snRNP非常柔性,未能解析到较高的分辨率,而U2 snRNP区域整体分辨率达到3Å,可以搭建原子模型。
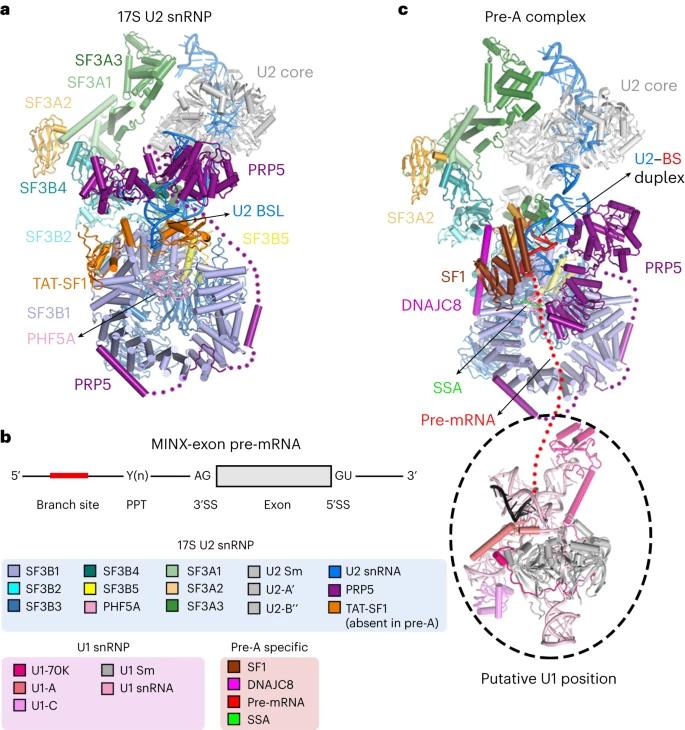
17S U2 snRNP和pre-A复合物的电镜结构
人 17S U2 snRNP 和 pre-A 复合物的结构分析提出了 BS 识别和校对的工作模型。尽管 PRP5 的 RNA 解旋酶结构域在这两种复合物中的位置完全不同,但酸性环和两个周围的螺旋以相同的方式锚定在 SF3B1 上(图 7a,b)。值得注意的是,PRP5结合的SF3B1以开放构象存在。相比之下,SF3B1 在组装的剪接体中采用封闭构象,其中 PPT 而不是 PRP5 的酸性环被容纳在 RNA 路径中(图 7c)。
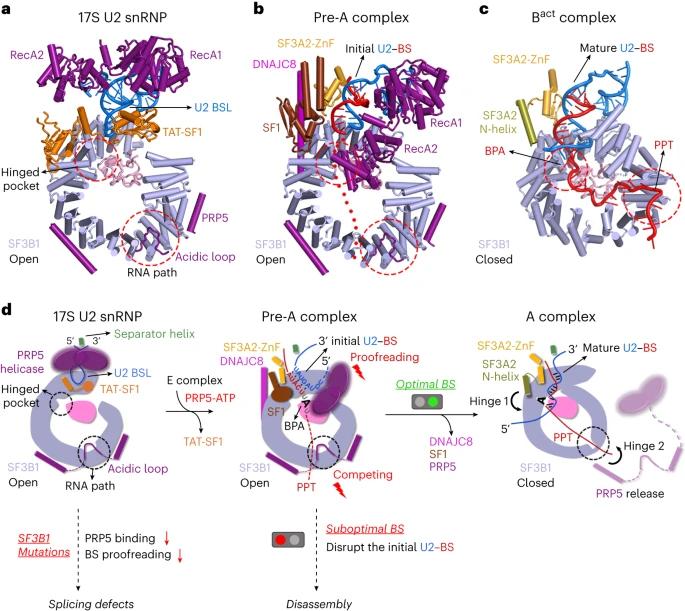
17S U2 snRNP到A complex过程中的结构变化以及PRP5校正U2/BS duplex的模型图
在组装 A 复合物的过程中,17S U2 snRNP 通过与 SF1 的相互作用被带入 BS 附近。然而,由于 TAT-SF1 的保护,前体 mRNA 无法进入 BSL(图 7a)。在 ATP 结合和水解的推动下,PRP5 可能拉动 U2 snRNA 的 5′-末端以解开双链 BSL,从而破坏其与 TAT-SF1 的相互作用(图 7d)。打开的 BSL 序列又与 BS 配对,形成初始 U2–BS 双工。在这种中间状态下,SF1 尚未与 BS 完全解离。相反,它将初始 U2–BS 双链体与 SF3A3、SF3A2-ZnF 和 PRP5 的解旋酶结构域结合在一起。DNAJC8 在铰链口袋的另一侧与 SF3B1 特异性相互作用(图 7d)。
尽管PRP5对BS的机制尚不清楚,但我们对17S U2 snRNP和pre-A复合物的结构提出了一种PRP5通过竞争机制校对初始U2-BS双链体的模型。在pre-A复合物中,PRP5的解旋酶结构域与初始U2-BS双链体密切相互作用,而PRP5的酸性环占据RNA路径,使其无法被pre-mRNA接近。涉及次优 BS 的初始 U2-BS 双链体更有可能屈服于 PRP5 的活性,导致次优 BS 与 U2 snRNA 解离。相反,涉及最佳 BS 的初始 U2-BS 双链体不太可能被 PRP5 破坏,从而为下游 PPT 和 3′SS 序列提供了更好的机会,从 RNA 路径中胜过 PRP5 的酸性环,最终导致 PRP5 解离。伴随着PRP5的释放,BPA被停靠在铰链袋中,SF3B1变成封闭的构象(图7d)。
研究结论
03
本研究,我们报告了导致前剪接体组装的两个连续复合物的原子结构:人 17S U2 snRNP 和交叉外显子 pre-A 复合物。PRP5 主要通过 PRP5 的酸性环占据 SF3B1 的 RNA 路径锚定在 17S U2 snRNP 上;PRP5 的解旋酶结构域与 U2 snRNA 相关;U2 snRNA 的 BS 相互作用茎环 (BSL) 被 TAT-SF1 屏蔽,无法与 BS 结合。在pre-A复合物中,形成初始的U2-BS双链体;PRP5 的易位解旋酶结构域与 U2 snRNA 保持在一起,酸性环仍占据 RNA 路径。pre-A 构象由剪接因子 SF1、DNAJC8 和 SF3A2 特异性稳定。SF3B1 中的癌症衍生突变破坏了其与 PRP5 的关联,从而影响了 BS 校对。总之,这些发现揭示了PRP5对剪接体前组装和BS选择或校对的关键见解。(转化医学网360zhyx.com)
参考资料:
https://www-nature-com-443.vpnm.ccmu.edu.cn/articles/s41594-023-01188-0
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发