【干货】用于准确检测点突变的ARMS-PCR方法
| 导读 | 全球首选原料供应商。 |
随着医学研究的不断推进,靶向治疗也日趋成熟。靶向治疗的前提是对药物的分子靶点进行基因检测,识别导致遗传性疾病或恶性肿瘤的基因突变。
ARMS-PCR是一种基于PCR的新型方法,可以检测多种DNA点突变。目前,它是癌症定制化基因鉴定最重要、最广泛的方法之一。其治疗用途的好处已得到现场专家的充分认可。
本文中将重点介绍ARMS-PCR的原理、优化及迈迪安优质分子原料在ARMS-PCR中的实例应用。

ARMS-PCR是什么
ARMS-PCR,扩增阻滞突变系统PCR (Amplification Refractory Mutation System PCR,ARMS-PCR),又称为等位基因特异性PCR(Allele-Specific PCR,AS-PCR)。
ARMS-PCR技术建立在等位基因特异性延伸反应基础上,只有当某个等位基因特异性引物的3’末端碱基与突变位点处碱基互补时,才能进行延伸反应。
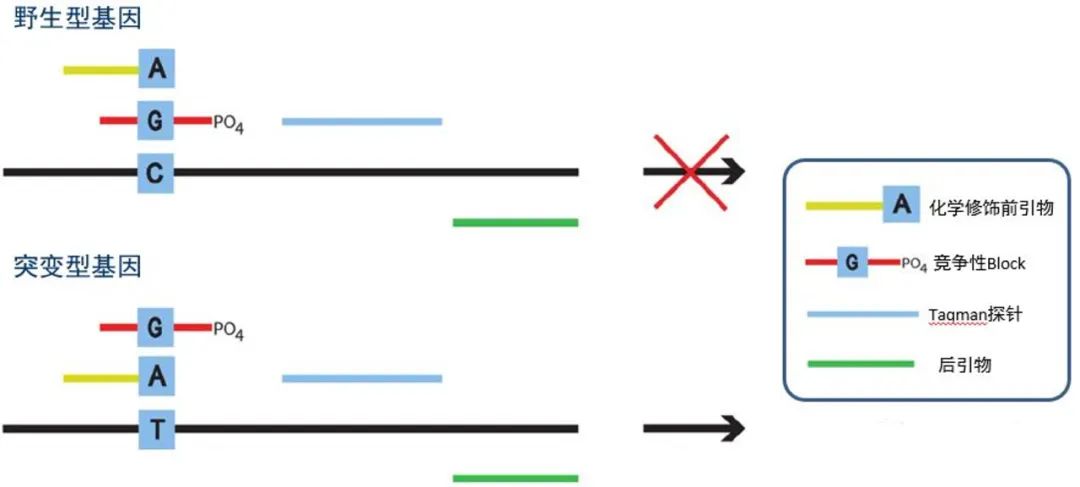
常规PCR扩增DNA所用的上、下游引物与靶序列完全匹配,而等位基因PCR采用等位基因特异的两条上游引物,两者在3’端核苷酸不同(图1),一个对野生型等位基因特异(MP-F),另一个对突变型等位基因特异(Primer-R),在Taq DNA聚合酶作用下,与模板不完全匹配的上游引物将不能退火,不能生成PCR产物,而与模板匹配的引物体系则可扩增出产物,通过凝胶电泳或者qPCR就能很容易地分辨出扩增产物的有无,从而确定SNP基因型。

图1 ARMS-PCR反应原理
目前市场主流为ARMS+qPCR技术,采用TaqMan探针进行检测(比如肿瘤靶向用药EGFR基因检测,CFDA批准的检测试剂盒,90%以上都是ARMS检测方法)。
ARMS-PCR优势
ARMS-PCR是一种高敏感性、高特异性、低成本的突变检测方法。
ARMS-PCR还有一个比较显著的优势,就是该检测设计扩增的DNA片段比普通DNA片段长,不管突变状态如何,突变位点两侧的共同区域都可以被扩增成独立的片段。这些扩增出来的独立片段是相同的,可用做DNA模板质量内参,对PCR反应也有潜在的抑制作用。
ARMS-PCR比直接测序有更高的灵敏度。一般来说,直接测序需要样本中突变的肿瘤细胞数目占可检测的所有肿瘤细胞数目的20%以上,而ARMS-PCR因为使用特异性探针扩增相应的突变序列,样本中突变的肿瘤细胞数目达可检测的所有肿瘤细胞数目的1%即可检测出突变。
ARMS-PCR的局限
ARMS-PCR的局限性在于,这种检测方法只能用于已知突变的检测,当然,如果已知突变占所检测位点的绝大部分(如EGFR,已知常见突变占所有突变的95%以上),这一局限性就无足轻重了。
另一个局限在于,虽然有了各种改进办法,但ARMS-PCR假阳性率仍然较高,这便限制了其突变检测灵敏度的进一步提高,难以实现对低于0.1%突变的检测。
假阳性怎么来的?
理论上Taq DNA聚合酶必须在引物3’末端碱基与模板完全互补情况下才能进行有效的聚合反应,但由于Taq DNA聚合酶严谨性受多因素影响,某些情况下,即使引物的3’末端碱基与模板不互补,延伸仍然可以进行(如果3′末端只有一个碱基的错配,那么是引物是可以错配结合的并可以进行延伸的,只是延伸的效率低于那些3′末端正好配对的引物),而且不同的3’末端错位(mismatch)有不同的延伸效率(如果在3′末端引入了其他的错配碱基,那么错配的数目太多或达到一定程度,那么3′末端无法进行延伸),因而仅靠引物3’末端一个碱基的错配不能充分而可靠地区分两个等位基因,进而造成假阳性结果。
如何提高ARMS-PCR的特异性
引物的优化是关键!
1. 四引物ARMS-PCR
四引物ARMS-PCR技术(Tetra-Primer ARMS-PCR)提高特异性的有效方法。
该检测中同时使用4条PCR引物(图2),两条3’末端位于SNP位点上的分属不同基因型的方向相反的内引物(inner Primer),两条位于SNP外侧并与SNP距离不等的外引物(outer Primer),4条引物理论上如果都匹配的话,两两组合可扩增出3条DNA产物(位于同一位点的两内引物无法产生长片段扩增产物,多为引物二聚体)。但若其中一条针对SNP的内引物不匹配,则只能扩增出另外两条DNA片段。
由于外引物到达SNP距离不同,扩增产物大小也就不同,通过电影根据局扩增产物的大小即可判断基因型,同时由外侧引物扩增的长片段产物可作为体系的阳性质控)。

图2 Tetra-Primer ARMS-PCR反应原理
2. 引入错配碱基
为了提高引物延伸的特异性,可在3’端倒数第2位或第3位碱基处引入一个错配碱基,该错配碱基与3’末端的错配碱基共同作用,使引物在与其3’末端不互补的模板中扩增产物率显著降低,而引物在与其3’末端互补的模板中正常扩增,引物的错配碱基类型取决于3’末端碱基错配类型。
注意:当3’末端是“强”错配(A/G或G/T)时,可以在引物中引入一个“弱”错配(C/A或C/T);当3’末端是“弱”错配时,则需要在引物中引入一个“强错配”;当3’末端是出“中度”错配(A/A、C/C、G/G、T/T)时,可以在引物中再引入一个“中度”错配。一般在3’末端引入突变(倒数第3个碱基),可以显著提高特异性。
如何提高ARMS-PCR的灵敏度
1. 使用Taqman-MGB探针
我们知道,TaqMan探针分别连有两种不同的荧光染料,5’端为荧光基团,3’端连有通用的荧光淬灭基团。一个完整的探针,淬灭基团和荧光基团在空间上特别靠近而产生荧光淬灭。正常情况下检测不到5’端荧光基团发出的荧光,只能检测到3’端淬灭基团的背景荧光。在靶基因扩增过程中,PCR引物和荧光标记探针在退火时均会与目标序列互补结合(Probe Tm比较高,需在Primer 之前与DNA Template 结合)。
Taq 酶在延伸模板链延伸时遇到与模板稳定结合的探针,Taq酶的5’-3’外切核酸酶会将与模板结合的特异性探针降解,从而使探针上的荧光基团因为物理空间分离,淬灭效应消失,发出荧光(图3)。如果荧光探针与目标序列存在错配,就会大大减少荧光的释放量。后续通过软件分析处理荧光数据而确定基因型。

图3 ARMS-Taqman检测原理
TaqMan-MGB探针技术是在TaqMan法基础上优化而成的一个SNP检测方法(由普通Taqman探针和MGB基团两部分组成),该探针的3’端结合了小沟结合物(minor groove binder,MGB),MGB与DNA螺旋的小沟(minor groove)契合,通过稳定DNA双螺旋结构来提高杂交的准确性和稳定性(图4)。

图4 Taqman-MGB检测原理
这使得探针长度进一步缩短,TM值较高,增加了探针的杂交稳定性,使结果更准确。该探针结合的为非荧光淬灭基因,这可大大降低荧光本底,提高反应灵敏度。MGB探针设计应使SNP位点处于探针中间1/3范围内,尽量缩短MGB探针长度,但不少于13个碱基。
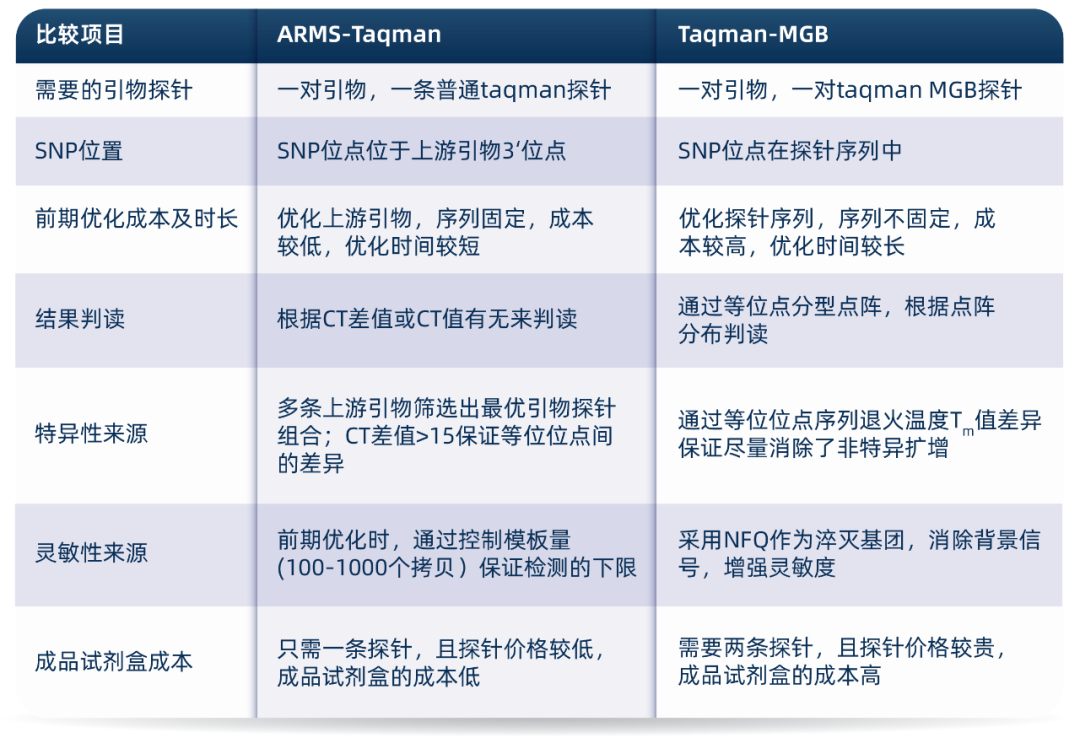
ARMS-Taqman vs Taqman-MGB
2. 使用竞争性Block
有一些ARMS-PCR检测添加Block(类似Taq man-MGB里面的MGB探针,一段Oligo序列)以封闭野生型,提高检测的灵敏度1。
Block添不添加主要的决定因素是引物的特异性如何,如果特异性不好可以考虑添加block提高检测灵敏度,其实引物足够好的话,block是不需要的。
Meridian 迈迪安用于ARMS-PCR的产品推荐
抗体热启动的DNA Taq聚合酶,搭配优化的先进缓冲液,具有快速、高特异、高灵敏和robust的特点,可实现高效的 ARMS-PCR 检测。
含有抗体热启动Taq聚合酶(MDX008)的即用型预混液,还包含了优化的Mg,dNTP及反应缓冲液。
又称为Immolase,化学热启动Taq聚合酶,搭配先进优化的反应缓冲液,低背景污染、更稳定、可实现高特异和高灵敏的 ARMS-PCR 检测。
产品优势:
⬤高选择性:能够识别多种基因突变;
⬤高灵敏度:突变引物可检测10ng/L DNA中低至0.5%浓度的突变;
⬤读起来简单:结果一目了然,评估客观,简单明了,不复杂;
⬤操作简单:兼容多种PCR设备,操作方式标准化,可机上检测90分钟内完成。
ARMS-PCR法的实例介绍
Meridian Fast qPCR Mix(MDX020)用于检测雄激素受体基因突变
位于 X 染色体的雄激素受体(AR)基因突变可能会导致雄激素不敏感综合征(AIS),AR基因中的G1733A(rs6152)突变与许多临床结果的风险增加有关,如雄激素性脱发、前列腺特异性抗原(PSA)升高、复发性自然流产、多囊卵巢综合征和心血管疾病等。采用ARMS-PCR方法可对rs6152上的A/G突变进行检测2。

针对该突变位点,设计了四个引物(FI,RI,FO,RO,Table1),PCR扩增使用Meridian的Fast qPCR Mix(MDX020):
PCR反应配制

PCR程序:
95oC初始变性2分钟,95oC变性30秒,63oC退火30秒,72oC延伸10秒,循环结束后72oC最终延伸5分钟。PCR产物经 1.5%琼脂糖凝胶电泳在100V下显影45分钟。
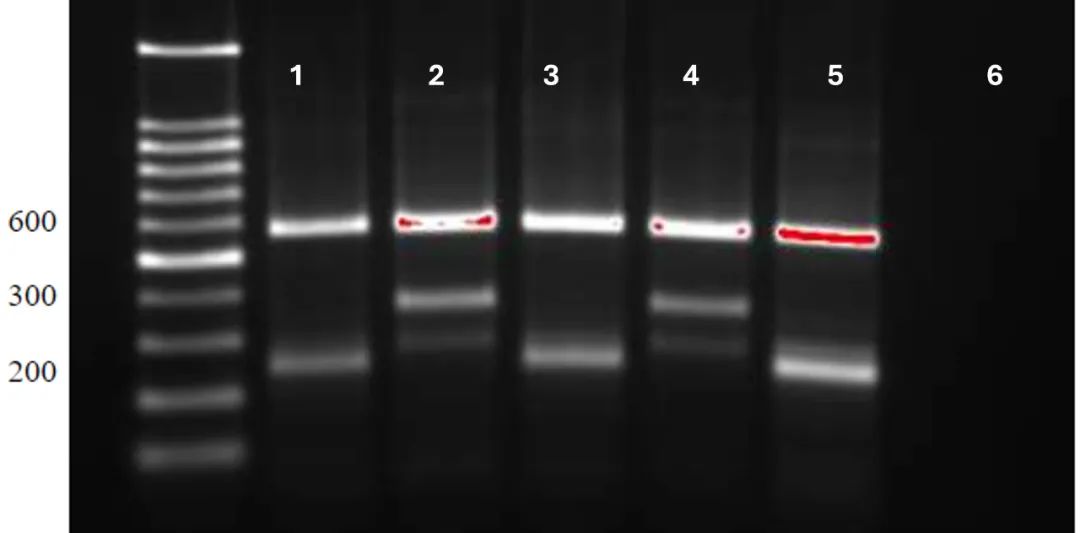
图5 rs6152 ARMS-PCR扩增产物电泳图
图5显示了PCR扩增结果,泳道1、3和5是G等位基因阳性的产物,带有572和245bp的条带;泳道2和4是A等位基因阳性的产物,带有572bp、375bp和一条非特异性条带;泳道6是阴性对照。
通过随机选取结果不同的 G 等位基因阳性样本(572和245 bp)和 A 等位基因阳性样本(572和375bp)进行测序验证。结果显示ARMS-PCR扩增结果与DNA测序结果一致(图6)。

图6 rs6152 的 DNA 测序结果。A)G 等位基因阳性;B)A 等位基因阳性(更多实验详情参考文献资料2)
Meridian Low DNA Taq (MDX009)用于遗传性耳聋基因突变检测
常州市第一人民医院早前建立了一种2D-PCR单管快速检测方法,针对导致遗传性耳聋的四种常见耳聋基因(GJB2、SLC26A4、GJB3和MT-RNR1)上9个突变位点的检测。该研究中,对 116 名聋哑学生的耳聋基因热点突变频率进行了分析3。
检测的引物设计结合了2D-PCR和 ARMS-PCR的原理:引物3′端的最后一个碱基带有标签,特异性识别野生型和突变型模板。为了提高扩增特异性,在带有标签的引物3ʹ端的前3-6个碱基处引入了人工错配碱基,同时检测张红设计3条不同的序列作为探针,分别用FAM、HEX和Alexa568标记。
将来自9个位点的野生型或纯合突变质粒(各5μl;1×106个拷贝)混合至终浓度约1×105个拷贝,并将混合质粒用作扩增的模板。
ARMS-PCR使用了Meridian的Low DNA Taq (MDX009)进行扩增:
PCR反应配制

PCR程序:
95℃初始变性10分钟, 95°C变性10秒和60°C延伸10秒,循环5次;35个循环,95°C 10 秒,72°C 1 秒,60°C 10 秒。温度以0.06℃/秒的升温速率从30℃逐渐升高至70℃,并连续获取荧光信号。根据FAM、HEX和Alexa568荧光通道的熔解曲线鉴定出9个位点的27个基因型。
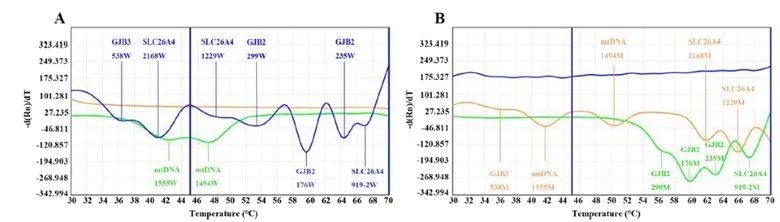
图7 多重探针扩增溶解曲线(更多实验详情参考文献资料3)
图7显示了使用多重探针的溶解曲线:根据熔解曲线和相应的熔解温度,FAM通道的熔解曲线均为野生型;HEX通道在<48℃时为野生型,在>48℃时为突变型;Alexa568通道的熔解曲线均为突变型。Sanger测序结果扩增结果和测序结果的一致性,验证了ARMS-PCR的可靠性和准确性。
↓欢迎联系我们咨询订购样品测试↓

扫描订购样品
参考文献:
1.https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0004584
2.http://seaninstitute.org/infor/index.php/pendidikan/article/view/1694/1399
3.https://doi.org/10.1038/s41598-023-50928-1
咨询详情订购样品:
电话:010-85660600
邮箱:info.cn@meridianlifescience.com

Meridian迈迪安致力于提供最高质量的分子原料酶制剂,全球研发生产基地均通过了 ISO 13485认证。我们始终坚持以客户为中心,以高质量的服务和产品为合作伙伴提供价值。
迈迪安产品主要优势包括:
一致性:单批次量产,保证可靠的检测
优质性能:通过严格质控,减少批间差及污染

美国迈迪安生物科技是一家大规模生产各种抗体,各种病毒抗原,各种重组蛋白质,各类 PCR 多聚酶,各种核苷酸和体外诊断关键试剂的大型领军企业。45年以来,迈迪安生命科学公司始终坚持以提供创新的生命科学解决方案和建立值得信赖的合作伙伴关系为我们的宗旨。我们的重点是为体外诊断试剂公司提供优质的原料和服务,使其有助于推动这些领域的发展。

 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发