苏佳灿教授团队:细菌外囊泡
| 导读 | 首次提出了基于合成生物学的BEVs定制化方法,丰富了基于BEVs的肠-骨轴概念,为复杂疾病的治疗提供创新的解决方案 |
细胞外囊泡(Extracellular Vesicles,EVs)是一种由细胞释放的具有磷脂双分子层且无法复制的无细胞体系,具有稳定的载药能力、特殊的纳米尺寸和良好的生物相容,是极具临床应用潜力的新型药物递送载体。苏佳灿教授团队在EVs领域中具有丰富的研究经验,已经发表了多篇EVs相关的高水平论文。但动物来源的EVs存在一些局限性,例如产量低、临床转化难、难以改造等。针对这一痛点,苏佳灿教授团队近年来重点关注了细菌外囊泡(Bacterial Extracellular Vesicles,BEVs),BEVs来源于肠道微生物,且易于产业化和易于工程改造,可规避MEVs大规模应用的问题。本文将详细介绍细菌外囊泡的生物发生、结构、组成、内化机制、修饰方法及其在复杂疾病中的应用。苏佳灿教授团队在国际上首次提出了基于合成生物学的BEVs定制化方法,丰富了基于BEVs的肠-骨轴概念,为复杂疾病的治疗提供创新的解决方案。
1.细菌外囊泡概况
1.1细菌外囊泡的生物起源、分类、结构和组成
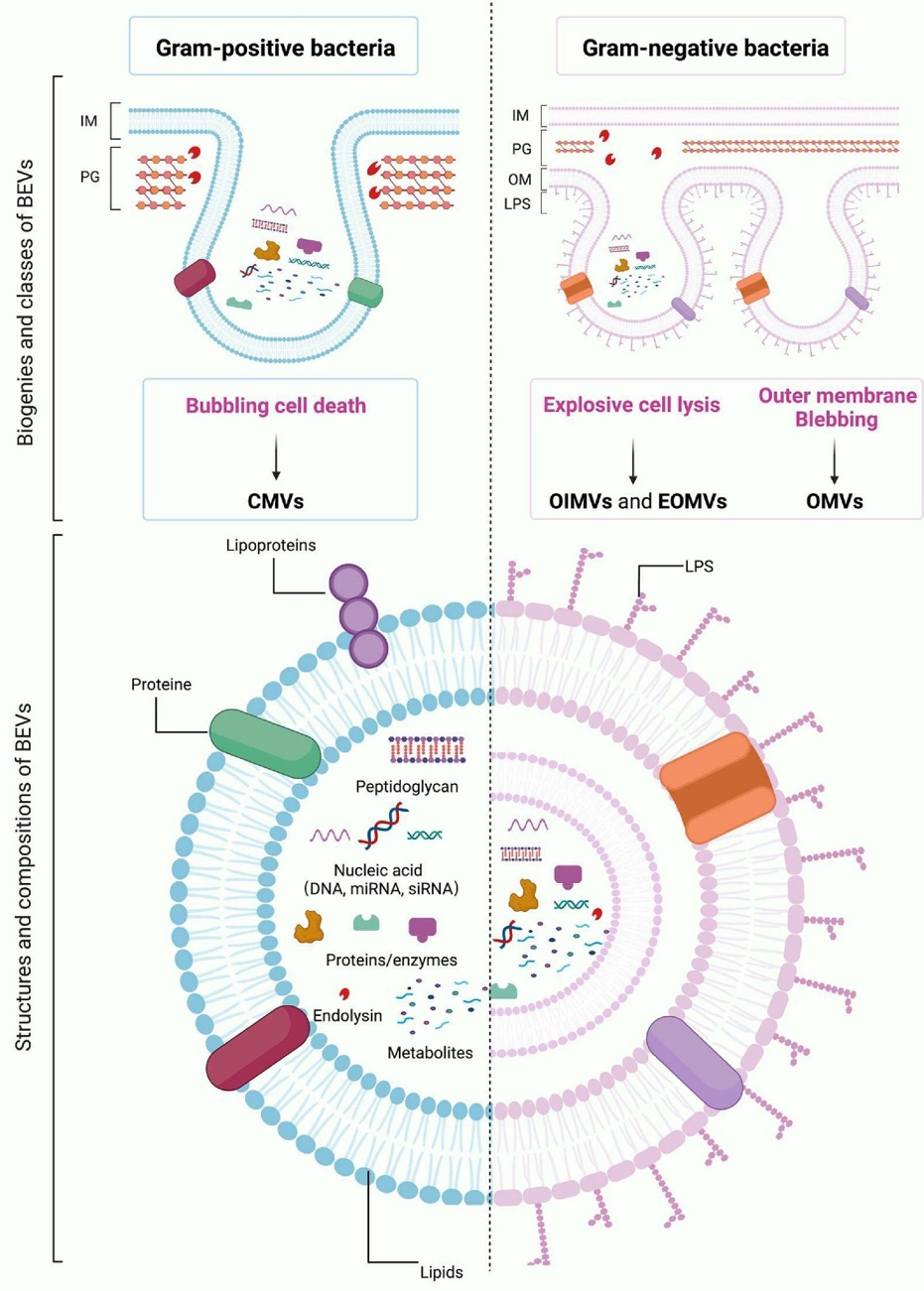
根据形态、结构和染色性质,细菌中的有益菌、有害菌和中性菌又可分为革兰氏阳性菌和革兰氏阴性菌。在20世纪60年代,BEVs首次在革兰氏阴性菌中被鉴定出来。直到革兰氏阴性菌中BEVs被发现的三十年后,才有报道发现革兰氏阳性菌中同样存在BEVs。与MEVs一样,在很长一段时间内,BEVs被视为“垃圾中转站”。但越来越多的证据表明,BEVs是能够将生物信号传递到其他细胞的通信介质,能够在多个维度上影响组织性能。
BEVs是一类直径范围为20至400 nm的球形膜纳米颗粒,革兰氏阳性和革兰氏阴性菌都可以自发且不消耗任何能量来产生BEVs。革兰氏阳性菌通过气泡细胞死亡机制产生BEVs,称为细胞质膜囊泡(Cytoplasmic membrane vesicles,CMVs)(图1左侧)。革兰氏阴性菌有两种途径产生BEVs,其中,内外膜细胞外囊(Outer-inner membrane vesicles, OIMVs)与爆炸性外膜囊泡(Explosive outer-membrane vesicles,EOMVs)通过爆炸性细胞裂解获得,而外膜囊泡(Outer membrane vesicles, OMVs)来自外膜起泡(图1右侧)。
BEVs的发生机制决定了它们的组成。通常,OMVs含有一些外膜蛋白,这是由于不平衡的细胞膜生物合成和疏水分子引发外膜起泡的生物学机制造成的。然而,CMVs和EOMVs/OIMVs富含肽聚糖(PG)、核酸(DNA和RNA)、蛋白质和代谢物,这分别是由于气泡细胞死亡和爆炸性细胞裂解的独特机制所造成的。通常来说,来自革兰氏阳性菌和革兰氏阴性菌的BEVs的组成的显著差异是脂多糖(LPS)的存在。据报道,富含LPS的致病性细菌(如大肠杆菌)产生的BEVs能够介导半胱天冬酶-11的活化或内在凋亡,这是其能够导致全身副作用的原因。然而,特殊革兰氏阴性菌(如益生菌大肠杆菌Nissle1917)和减毒株(如msbA、msbB、lpxL1或lpxM突变株)来源的BEVs则不含完整的LPS。这些基因的缺失导致LPS的侧链酰化不足,并表现出对人细胞的内毒性和免疫原性降低。因此,由于其增强的安全性,源自益生菌或减毒菌株的BEVs通常被用于治疗骨相关疾病 [1-5]。
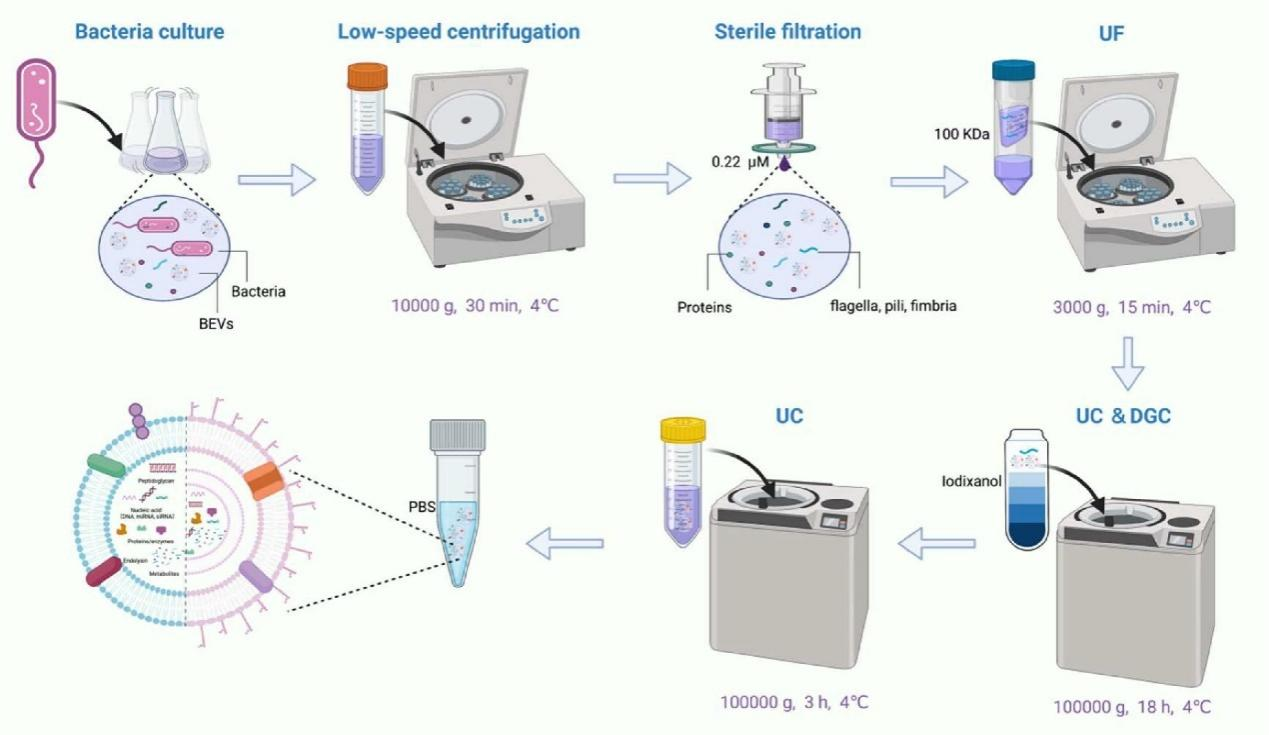
为了获得高质量的BEVs,目前已经开发了多种分离技术以从发酵液中提取BEVs,这是其后续能够得到应用的关键。目前用于BEVs分离的方法主要包括:超离心(UC)、超滤(UF)、沉淀、亲和分离、尺寸排阻色谱(SEC)和密度梯度离心(DGC)。但是不同的分离技术各有其优缺点,在大多数情况下,上述技术可以达到足够的产率和纯度。然而,在复杂的发酵培养基中,通常需要不同分离方法的组合来去除污染物。例如,益生菌的发酵培养基中,嗜粘蛋白Akkermansia muciniphila(AKK)与猪粘蛋白难以分离,这大大增加了培养基的复杂性。
已有研究开发了结合UC、UF和DGC等方法收集AKK衍生的BEVs。此外,一些苛养菌如Helicobacter pylori和Neisseria meningitidis不能在无血清培养基中生长。Tulkens等人结合UC、SEC和DGC等方法从复杂培养基中分离得到了BEVs。我们设计了一种对多种细菌有效的组合分离方法(图2)。使用这种分离方法,我们成功地获得了来自不同益生菌的BEVs,如bacillus rhamnosus GG(LGG)和Escherichia coli Nissle 1917,具有高纯度和高均一性。在BEVs分离后,使用透射电子显微镜(TEM)和纳米颗粒跟踪分析(NTA)可以表征BEVs的形状、尺寸和浓度。值得注意的是,由于缺乏天然BEVs的特异性标志物,许多研究没有使用蛋白质印迹法(WB)来表征BEVs。然而,工程化BEVs可使用WB来进行表征 [1-5]。
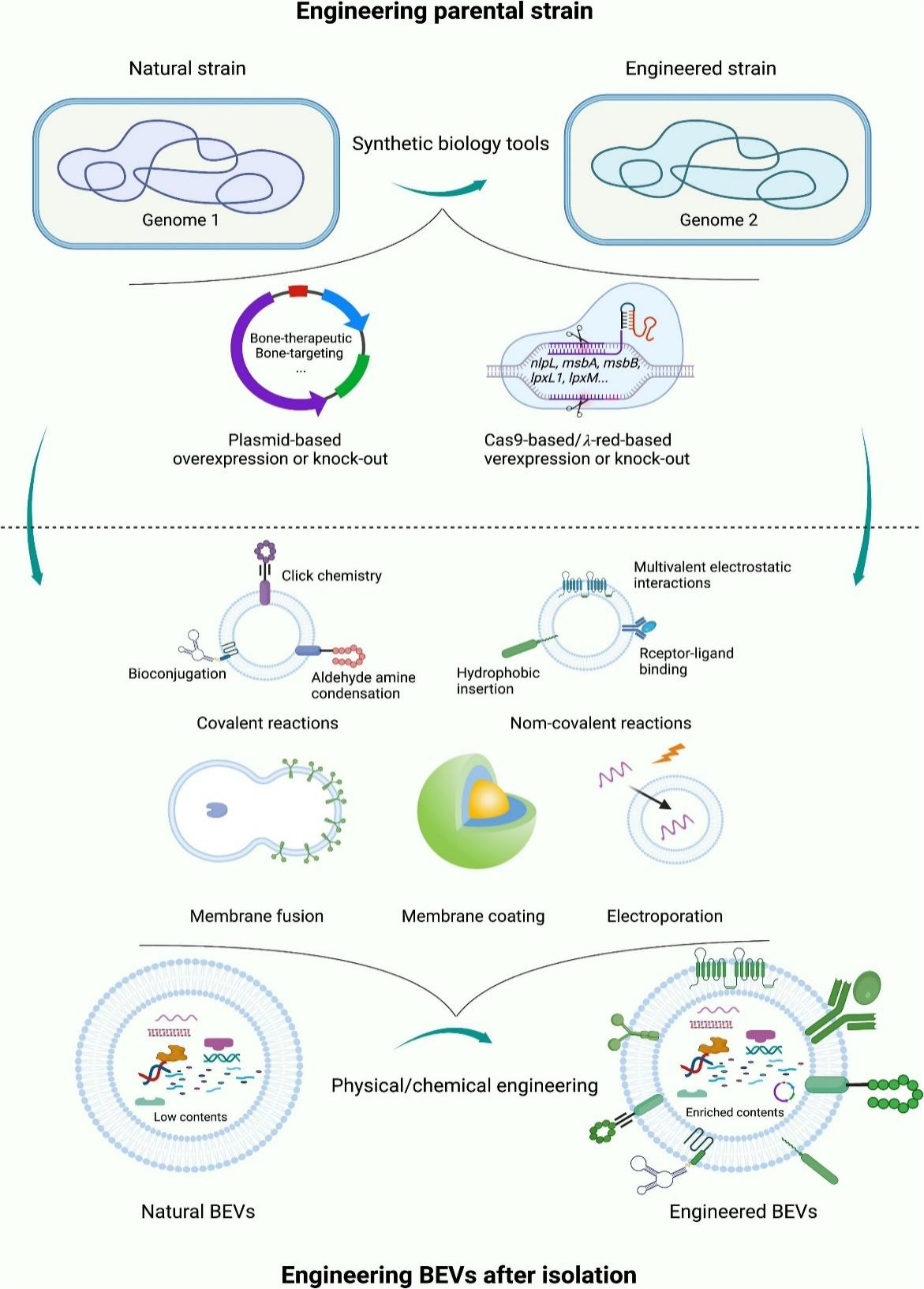
如上所述,BEVs由于其独特的无细胞体系、纳米结构、低毒性、载药能力、良好的生物相容性等特点,十分有潜力成为治疗OP的平台。尽管BEVs作为OP的治疗载体显示出巨大的潜力,但天然BEVs仍有几个缺点,例如靶向能力差和治疗效率不高等。在我们之前的研究中,我们使用工程方法构建了多种功能化的MEVs用于治疗OP。然而,低提取效率和困难的工程改造严重阻碍了MEVs的发展。并且对于BEVs来说,易于改装和工业化是其重要的优势之一。通过多种途径修饰BEVs,包括工程化改造亲本菌株以产生治疗性BEVs和分离后对BEVs进行工程化改造,对BEVs在OP治疗中的重要作用和良好效果奠定基础(图3) [1-5]。
苏佳灿教授团队近年来重点关注了天然与工程化细菌外囊泡在骨质疏松症、骨与软组织肿瘤与中枢神经系统等复杂疾病中的应用(图4)。
苏佳灿教授团队首先开发了一种基于益生菌鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG, LGG)来源的BEVs递送系统(图5)。我们将骨靶向肽SDSSD锚定在LGG-EVs膜上,这使得LGG-EVs能够靶向递送内源miRNA至骨微环境。骨靶向LGG-EVs(BT-LGG-EVs)表现出良好的骨靶向能力且没有明显的毒性。在体外实验中,BT-LGG-EVs不仅能促进成骨分化和矿化,还能抑制破骨细胞形成。在体内实验中,BT-LGG-EVs被证明能够改善小鼠骨质疏松表型。这一研究表明,BT-LGG-EVs有望成为治疗OP的创新、安全且有效的解决方案 [6]。
骨和软组织肿瘤(Bone and soft tissue tumors, BSTT)约占成人恶性肿瘤的1%,约占儿科肿瘤的20%。全世界每年有近20万人被诊断出患有BSTT。作为一个多样化和异质性的群体,BSTT肿瘤包括50多种亚型,其中约一半是发生在四肢的肌肉骨骼肿瘤。BSTT的分布部位主要包括头颈部、皮肤、躯干、四肢等部位。目前,BSTT的主要治疗方法是手术和化疗的结合。此外,一些治疗方法如基因治疗和免疫治疗也取得了一定的效果。然而,目前针对原发性恶性BSTT的治疗进展仍然缓慢,患者的临床结果没有得到显着改善。因此,迫切需要探索BSTT的创新治疗策略。
EVs与BSTT之间的关系备受关注。随着对人类微生物群在健康和疾病中的作用的不断认识,人们对于微生物的BEVs在微生物群-宿主通讯中的作用的了解不断加深。人们认为BEVs通过转移其包括核酸(DNA、RNA、miRNA)、蛋白质(细胞质和外质蛋白)、代谢产物、脂多糖(LPS)和肽聚糖在内的内容,来调节细胞间的通讯。微生物和EVs的交叉研究正在成为生物医学领域的重要方向。近年来,BEVs在参与健康调节和导致疾病发生等方面的作用越来越受到人们的关注。BEVs可以进入全身循环并在人体液中检测到,这有利于促进微生物组研究、液体活检技术和基于BEVs的治疗的发展。重要的是,细菌具有快速增殖和成熟的高密度培养等优势,基于BEVs的治疗是克服MEVs和其他合成纳米材料相关的大规模生产问题的一种有前途的策略。此外,合成生物学的进步也使得利用工程化BEVs精确地传递药物到癌细胞或组织成为可能。凭借纳米级结构、安全性、稳定的载荷能力、良好的生物相容性、易于修饰和生产等优势,BEVs已成为新型药物传递载体和重要的信号介质,具有巨大的临床应用潜力。总之,BEVs的开发及其在BSTT治疗中的应用具有重要意义(图8) [4]。
尽管过去几十年来诊断和治疗方法不断进步,但阿尔茨海默病(AD)、帕金森病(PD)和脑肿瘤等中枢神经系统疾病仍是全球主要的健康挑战。随着发达国家人口结构的变化和人口老龄化程度的加深,中枢神经系统疾病的发病率不断上升,给患者家庭带来了沉重的负担。目前,大多数中枢神经系统疾病都缺乏有效的治疗策略。血脑屏障(Blood-Brain barrier, BBB)是一种物理屏障,它能够通过调节分子的运输来保护大脑微环境,并将体循环与大脑环境隔开。这道屏障在保护大脑的同时,也使药物分子难以进入大脑发挥治疗效果。此外,考虑到所使用的药物可能具有较弱的毒性,可能会对大脑产生副作用,这使得治疗中枢神经系统疾病的药物开发充满挑战。
随着纳米技术的发展及其在生物医学领域的应用,目前已经涌现出许多纳米诊断和治疗系统,具有克服BBB以实现对CNS疾病的高精度治疗的潜力。因此,开发具有穿透血脑屏障能力的生物纳米材料,有望为CNS疾病的治疗带来革命性的改变。
随着对人体内源性通路研究的不断深入,人们发现肠道菌群与大脑之间存在着双向信息交换网络。研究表明,肠道菌群对中枢神经系统的发育和功能具有重要影响。然而,益生菌与人体之间的交流并不是通过直接的细胞接触实现的。活细胞分泌的EVs被证明是递送的良好载体,越来越多的证据表明,益生菌能够通过分泌EVs来调节宿主信号通路并将生物活性分子递送到宿主细胞来调节远端器官功能。 全面了解以 BEVs 为基础的肠-脑轴,有助于开发治疗中枢神经系统疾病的新方法(图9) [9]。
[1] Jiacan Su* et al. Engineered mammalian and bacterial extracellular vesicles as promising nanocarriers for targeted therapy. Extracellular Vesicles and Circulating Nucleic Acids. 2022;3(2):63-86.
[2] Jiacan Su* et al.. Bacterial extracellular vesicles as bioactive nanocarriers for drug delivery: Advances and perspectives. Bioactive Materials. 2022;14:169-81.
[3] Jiacan Su* et al. Engineered bacterial extracellular vesicles for osteoporosis therapy. Chemical Engineering Journal. 2022;450:138309.
[4] Jiacan Su* et al. Bacterial extracellular vesicles-based therapeutic strategies for bone and soft tissue tumors therapy. Theranostics. 2022;12(15):6576-94.
[5] Jiacan Su* et al. Extracellular derivatives for bone metabolism. Journal of Advanced Research. 2024.
[6] Jiacan Su* et al. Bone-targeted engineered bacterial extracellular vesicles delivering miRNA to treat osteoporosis. Composites Part B: Engineering. 2023;267:111047.
[7] Jiacan Su* et al. Bone-targeted bioengineered bacterial extracellular vesicles delivering siRNA to ameliorate osteoporosis. Composites Part B: Engineering. 2023;255:110610.
[8] Jiacan Su* et al. Synthetic biology-based bacterial extracellular vesicles displaying BMP-2 and CXCR4 to ameliorate osteoporosis. Journal of Extracellular Vesicles. 2024;13(4):e12429.
[9] Jiacan Su* et al. Engineered bacterial extracellular vesicles for central nervous system diseases. Journal of Controlled Release. 2023;364:46-60.
1.细菌外囊泡概况
1.1细菌外囊泡的生物起源、分类、结构和组成
根据形态、结构和染色性质,细菌中的有益菌、有害菌和中性菌又可分为革兰氏阳性菌和革兰氏阴性菌。在20世纪60年代,BEVs首次在革兰氏阴性菌中被鉴定出来。直到革兰氏阴性菌中BEVs被发现的三十年后,才有报道发现革兰氏阳性菌中同样存在BEVs。与MEVs一样,在很长一段时间内,BEVs被视为“垃圾中转站”。但越来越多的证据表明,BEVs是能够将生物信号传递到其他细胞的通信介质,能够在多个维度上影响组织性能。
BEVs是一类直径范围为20至400 nm的球形膜纳米颗粒,革兰氏阳性和革兰氏阴性菌都可以自发且不消耗任何能量来产生BEVs。革兰氏阳性菌通过气泡细胞死亡机制产生BEVs,称为细胞质膜囊泡(Cytoplasmic membrane vesicles,CMVs)(图1左侧)。革兰氏阴性菌有两种途径产生BEVs,其中,内外膜细胞外囊(Outer-inner membrane vesicles, OIMVs)与爆炸性外膜囊泡(Explosive outer-membrane vesicles,EOMVs)通过爆炸性细胞裂解获得,而外膜囊泡(Outer membrane vesicles, OMVs)来自外膜起泡(图1右侧)。
BEVs的发生机制决定了它们的组成。通常,OMVs含有一些外膜蛋白,这是由于不平衡的细胞膜生物合成和疏水分子引发外膜起泡的生物学机制造成的。然而,CMVs和EOMVs/OIMVs富含肽聚糖(PG)、核酸(DNA和RNA)、蛋白质和代谢物,这分别是由于气泡细胞死亡和爆炸性细胞裂解的独特机制所造成的。通常来说,来自革兰氏阳性菌和革兰氏阴性菌的BEVs的组成的显著差异是脂多糖(LPS)的存在。据报道,富含LPS的致病性细菌(如大肠杆菌)产生的BEVs能够介导半胱天冬酶-11的活化或内在凋亡,这是其能够导致全身副作用的原因。然而,特殊革兰氏阴性菌(如益生菌大肠杆菌Nissle1917)和减毒株(如msbA、msbB、lpxL1或lpxM突变株)来源的BEVs则不含完整的LPS。这些基因的缺失导致LPS的侧链酰化不足,并表现出对人细胞的内毒性和免疫原性降低。因此,由于其增强的安全性,源自益生菌或减毒菌株的BEVs通常被用于治疗骨相关疾病 [1-5]。

图1 BEVs的生物起源、分类、结构和组成
1.2 细菌外囊泡的分离为了获得高质量的BEVs,目前已经开发了多种分离技术以从发酵液中提取BEVs,这是其后续能够得到应用的关键。目前用于BEVs分离的方法主要包括:超离心(UC)、超滤(UF)、沉淀、亲和分离、尺寸排阻色谱(SEC)和密度梯度离心(DGC)。但是不同的分离技术各有其优缺点,在大多数情况下,上述技术可以达到足够的产率和纯度。然而,在复杂的发酵培养基中,通常需要不同分离方法的组合来去除污染物。例如,益生菌的发酵培养基中,嗜粘蛋白Akkermansia muciniphila(AKK)与猪粘蛋白难以分离,这大大增加了培养基的复杂性。
已有研究开发了结合UC、UF和DGC等方法收集AKK衍生的BEVs。此外,一些苛养菌如Helicobacter pylori和Neisseria meningitidis不能在无血清培养基中生长。Tulkens等人结合UC、SEC和DGC等方法从复杂培养基中分离得到了BEVs。我们设计了一种对多种细菌有效的组合分离方法(图2)。使用这种分离方法,我们成功地获得了来自不同益生菌的BEVs,如bacillus rhamnosus GG(LGG)和Escherichia coli Nissle 1917,具有高纯度和高均一性。在BEVs分离后,使用透射电子显微镜(TEM)和纳米颗粒跟踪分析(NTA)可以表征BEVs的形状、尺寸和浓度。值得注意的是,由于缺乏天然BEVs的特异性标志物,许多研究没有使用蛋白质印迹法(WB)来表征BEVs。然而,工程化BEVs可使用WB来进行表征 [1-5]。

图2 BEVs的分离方法概述
1.3 细菌外囊泡的工程化修饰方法如上所述,BEVs由于其独特的无细胞体系、纳米结构、低毒性、载药能力、良好的生物相容性等特点,十分有潜力成为治疗OP的平台。尽管BEVs作为OP的治疗载体显示出巨大的潜力,但天然BEVs仍有几个缺点,例如靶向能力差和治疗效率不高等。在我们之前的研究中,我们使用工程方法构建了多种功能化的MEVs用于治疗OP。然而,低提取效率和困难的工程改造严重阻碍了MEVs的发展。并且对于BEVs来说,易于改装和工业化是其重要的优势之一。通过多种途径修饰BEVs,包括工程化改造亲本菌株以产生治疗性BEVs和分离后对BEVs进行工程化改造,对BEVs在OP治疗中的重要作用和良好效果奠定基础(图3) [1-5]。

图3 修饰BEVs的工程化方法
2.细菌外囊泡在复杂疾病中的应用苏佳灿教授团队近年来重点关注了天然与工程化细菌外囊泡在骨质疏松症、骨与软组织肿瘤与中枢神经系统等复杂疾病中的应用(图4)。
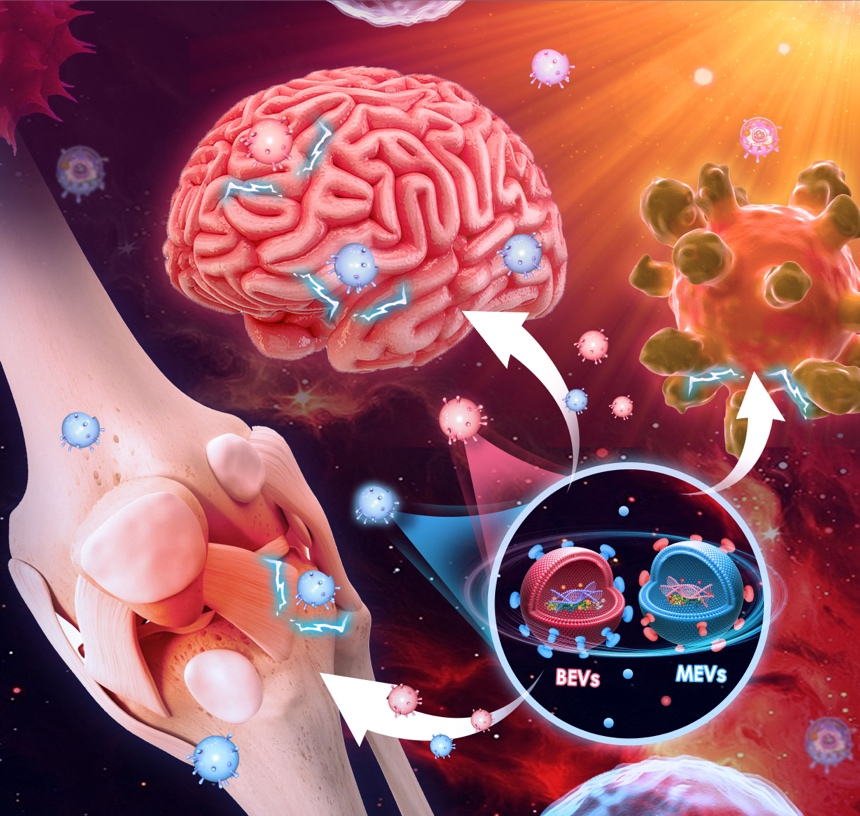
图4细菌外囊泡在骨质疏松症、肿瘤与脑等复杂疾病中的应用
2.1细菌外囊泡在骨质疏松症中的应用苏佳灿教授团队首先开发了一种基于益生菌鼠李糖乳杆菌GG(Lactobacillus rhamnosus GG, LGG)来源的BEVs递送系统(图5)。我们将骨靶向肽SDSSD锚定在LGG-EVs膜上,这使得LGG-EVs能够靶向递送内源miRNA至骨微环境。骨靶向LGG-EVs(BT-LGG-EVs)表现出良好的骨靶向能力且没有明显的毒性。在体外实验中,BT-LGG-EVs不仅能促进成骨分化和矿化,还能抑制破骨细胞形成。在体内实验中,BT-LGG-EVs被证明能够改善小鼠骨质疏松表型。这一研究表明,BT-LGG-EVs有望成为治疗OP的创新、安全且有效的解决方案 [6]。
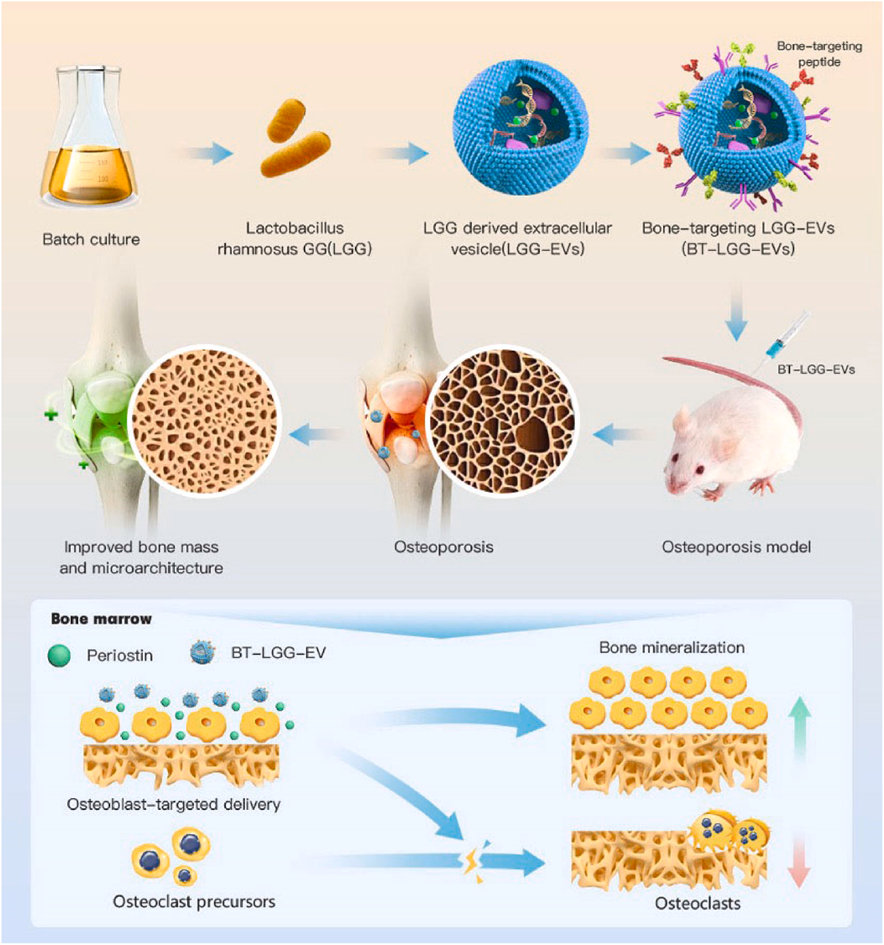
图5 BT-LGG-EVs的制备及抗骨质疏松机制探讨
随后,苏佳灿教授团队利用合成生物学手段改造益生菌大肠杆菌Nissle 1917(DE3)(ECN)使其融合表达ClyA与CXCR4。并进一步利用电转手段修饰BEVs-CXCR4(BEVs-C),从而装载SOST siRNA以生成BEVs-CXCR4-SOST siRNA(BEVs-CS)(图6)。定制的BEVs-CSs表现出良好的骨靶向能力且没有明显的细胞毒性。在体外实验中,BEVs-CS可以被BMSCs内化并促进其成骨分化,且具有良好的生物相容性。在体内实验中,BEV-CS成功逆转了卵巢切除小鼠的OP表型。这一研究表明,基于BEVs 的工程化策略为难治性OP治疗提供了一种创新、安全、高效且有前景的治疗解决方案 [7]。
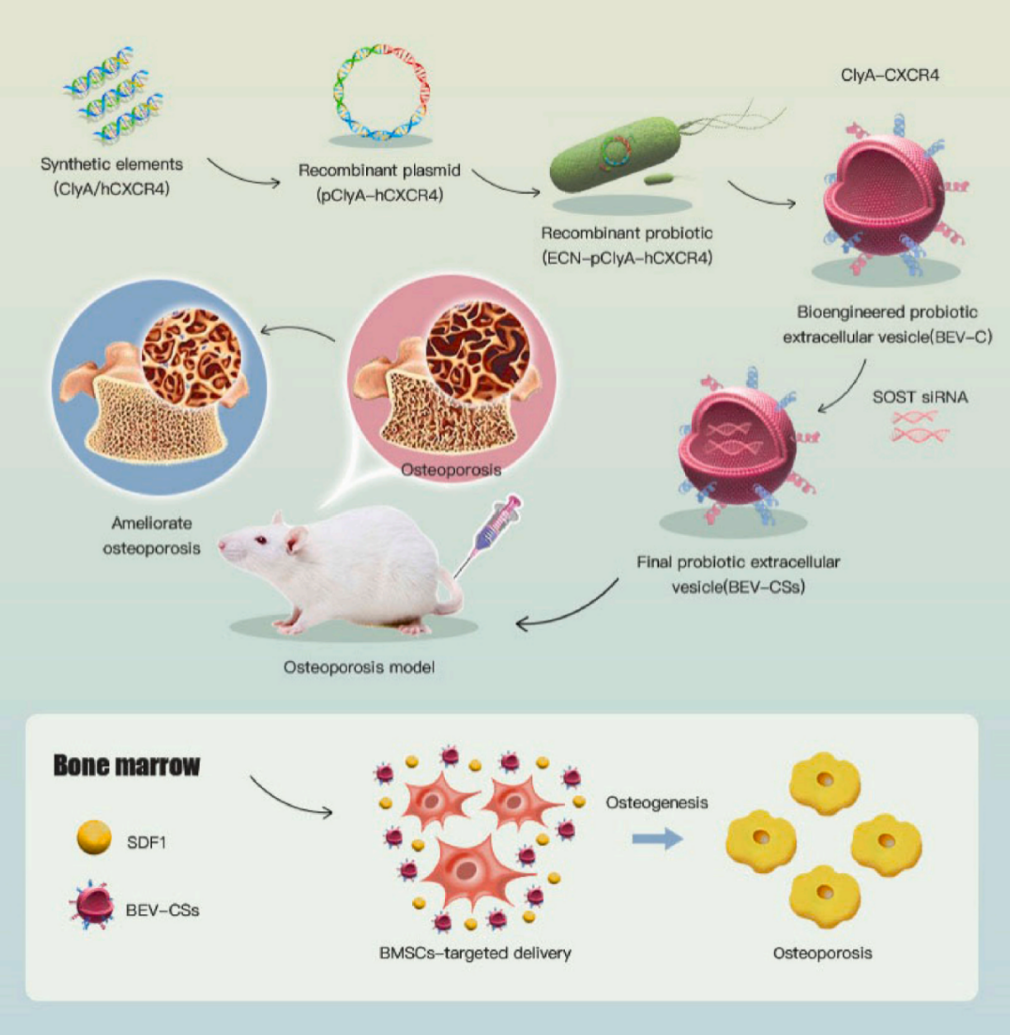
图6 工程化BEVs的构建和抗OP机制示意图
最后,苏佳灿教授团队利用合成生物性手段进一步构建了重组益生菌ECN-pET28a-ClyA-BMP-2-CXCR4(ECN-pClyA-BMP-2-CXCR4),其中BMP-2和CXCR4与BEVs表面蛋白ClyA融合过表达(图7)。工程化BEVs-BC在体内表现出良好的骨靶向性。在体外实验中,BEVs-BC具有良好的生物相容性和显著的促BMSCs成骨分化能力。在体内实验中,工程化BEVs-BC有效改善了卵巢切除小鼠OP表型。综上所述,我们利用合成生物学一步构建了具有骨靶向和骨形成功能的BEVs-BC,为OP提供了一种有效的策略,具有巨大的产业化潜力 [8]。
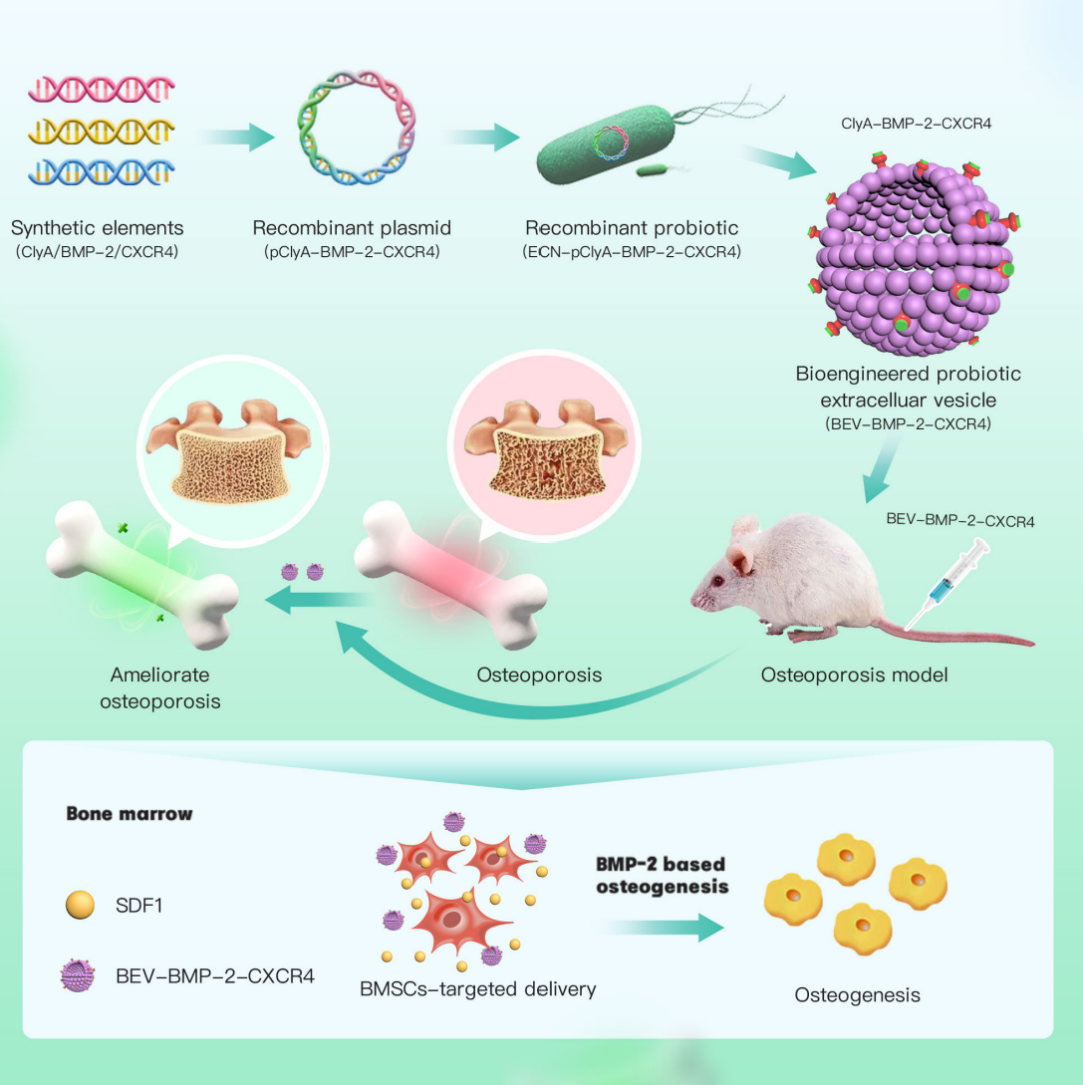
图7 基于合成生物学一步构建BEVs及其治疗OP的机制
2.2细菌外囊泡在骨与软组织肿瘤中的应用骨和软组织肿瘤(Bone and soft tissue tumors, BSTT)约占成人恶性肿瘤的1%,约占儿科肿瘤的20%。全世界每年有近20万人被诊断出患有BSTT。作为一个多样化和异质性的群体,BSTT肿瘤包括50多种亚型,其中约一半是发生在四肢的肌肉骨骼肿瘤。BSTT的分布部位主要包括头颈部、皮肤、躯干、四肢等部位。目前,BSTT的主要治疗方法是手术和化疗的结合。此外,一些治疗方法如基因治疗和免疫治疗也取得了一定的效果。然而,目前针对原发性恶性BSTT的治疗进展仍然缓慢,患者的临床结果没有得到显着改善。因此,迫切需要探索BSTT的创新治疗策略。
EVs与BSTT之间的关系备受关注。随着对人类微生物群在健康和疾病中的作用的不断认识,人们对于微生物的BEVs在微生物群-宿主通讯中的作用的了解不断加深。人们认为BEVs通过转移其包括核酸(DNA、RNA、miRNA)、蛋白质(细胞质和外质蛋白)、代谢产物、脂多糖(LPS)和肽聚糖在内的内容,来调节细胞间的通讯。微生物和EVs的交叉研究正在成为生物医学领域的重要方向。近年来,BEVs在参与健康调节和导致疾病发生等方面的作用越来越受到人们的关注。BEVs可以进入全身循环并在人体液中检测到,这有利于促进微生物组研究、液体活检技术和基于BEVs的治疗的发展。重要的是,细菌具有快速增殖和成熟的高密度培养等优势,基于BEVs的治疗是克服MEVs和其他合成纳米材料相关的大规模生产问题的一种有前途的策略。此外,合成生物学的进步也使得利用工程化BEVs精确地传递药物到癌细胞或组织成为可能。凭借纳米级结构、安全性、稳定的载荷能力、良好的生物相容性、易于修饰和生产等优势,BEVs已成为新型药物传递载体和重要的信号介质,具有巨大的临床应用潜力。总之,BEVs的开发及其在BSTT治疗中的应用具有重要意义(图8) [4]。
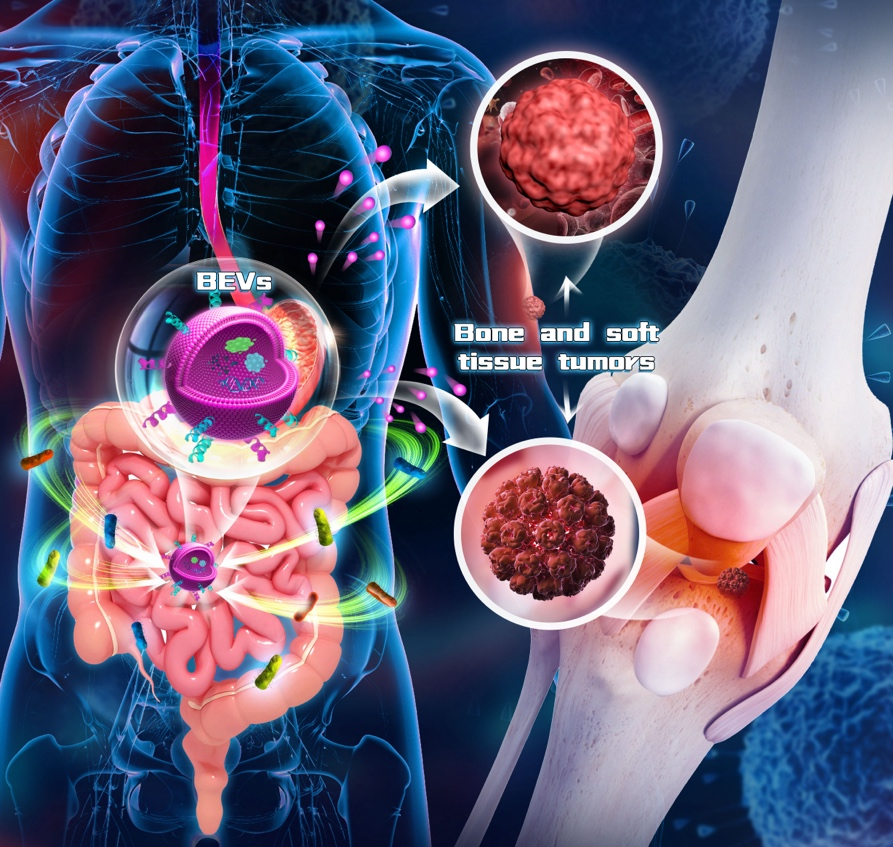
图8 基于BEVs的骨与软组织肿瘤治疗意义重大
2.3细菌外囊泡在中枢神经系统中的应用尽管过去几十年来诊断和治疗方法不断进步,但阿尔茨海默病(AD)、帕金森病(PD)和脑肿瘤等中枢神经系统疾病仍是全球主要的健康挑战。随着发达国家人口结构的变化和人口老龄化程度的加深,中枢神经系统疾病的发病率不断上升,给患者家庭带来了沉重的负担。目前,大多数中枢神经系统疾病都缺乏有效的治疗策略。血脑屏障(Blood-Brain barrier, BBB)是一种物理屏障,它能够通过调节分子的运输来保护大脑微环境,并将体循环与大脑环境隔开。这道屏障在保护大脑的同时,也使药物分子难以进入大脑发挥治疗效果。此外,考虑到所使用的药物可能具有较弱的毒性,可能会对大脑产生副作用,这使得治疗中枢神经系统疾病的药物开发充满挑战。
随着纳米技术的发展及其在生物医学领域的应用,目前已经涌现出许多纳米诊断和治疗系统,具有克服BBB以实现对CNS疾病的高精度治疗的潜力。因此,开发具有穿透血脑屏障能力的生物纳米材料,有望为CNS疾病的治疗带来革命性的改变。
随着对人体内源性通路研究的不断深入,人们发现肠道菌群与大脑之间存在着双向信息交换网络。研究表明,肠道菌群对中枢神经系统的发育和功能具有重要影响。然而,益生菌与人体之间的交流并不是通过直接的细胞接触实现的。活细胞分泌的EVs被证明是递送的良好载体,越来越多的证据表明,益生菌能够通过分泌EVs来调节宿主信号通路并将生物活性分子递送到宿主细胞来调节远端器官功能。 全面了解以 BEVs 为基础的肠-脑轴,有助于开发治疗中枢神经系统疾病的新方法(图9) [9]。
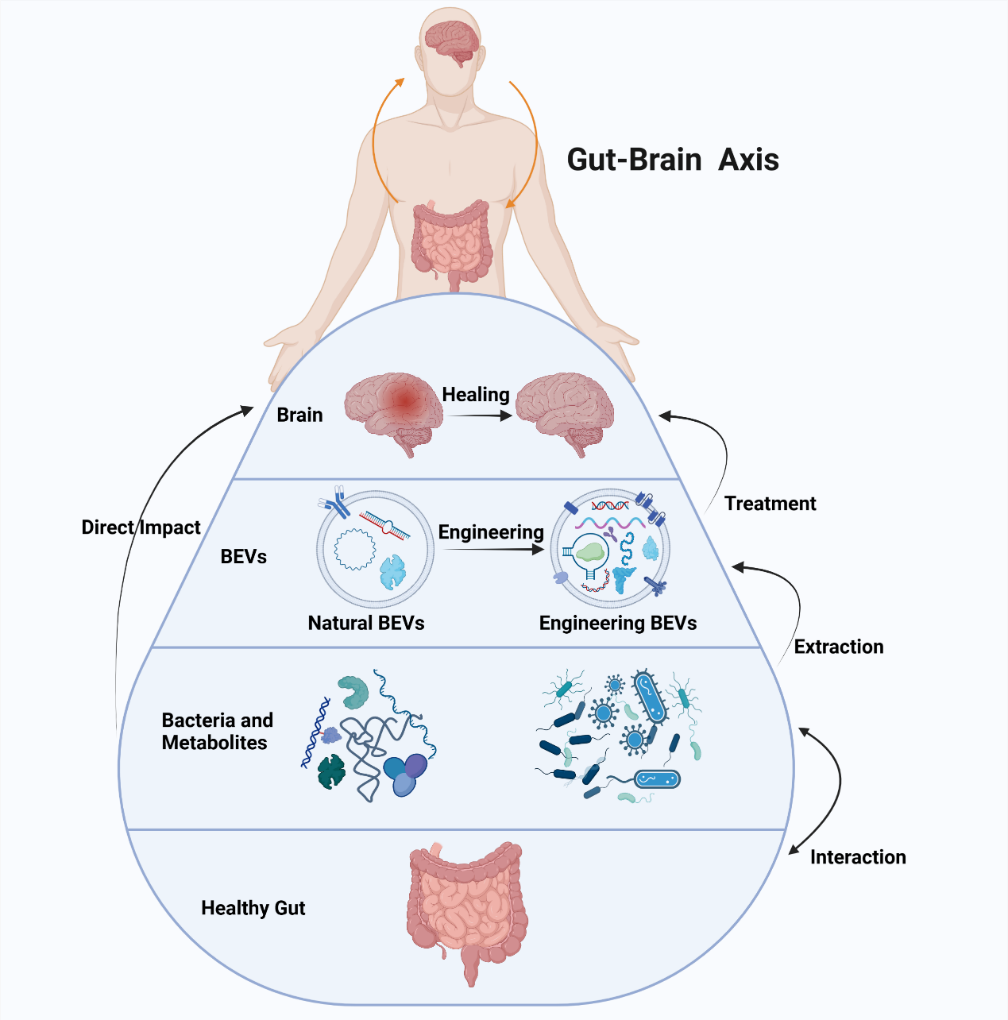
图9 天然和工程化BEVs在中枢神经系统疾病治疗中的应用具有重要意义
参考文献[1] Jiacan Su* et al. Engineered mammalian and bacterial extracellular vesicles as promising nanocarriers for targeted therapy. Extracellular Vesicles and Circulating Nucleic Acids. 2022;3(2):63-86.
[2] Jiacan Su* et al.. Bacterial extracellular vesicles as bioactive nanocarriers for drug delivery: Advances and perspectives. Bioactive Materials. 2022;14:169-81.
[3] Jiacan Su* et al. Engineered bacterial extracellular vesicles for osteoporosis therapy. Chemical Engineering Journal. 2022;450:138309.
[4] Jiacan Su* et al. Bacterial extracellular vesicles-based therapeutic strategies for bone and soft tissue tumors therapy. Theranostics. 2022;12(15):6576-94.
[5] Jiacan Su* et al. Extracellular derivatives for bone metabolism. Journal of Advanced Research. 2024.
[6] Jiacan Su* et al. Bone-targeted engineered bacterial extracellular vesicles delivering miRNA to treat osteoporosis. Composites Part B: Engineering. 2023;267:111047.
[7] Jiacan Su* et al. Bone-targeted bioengineered bacterial extracellular vesicles delivering siRNA to ameliorate osteoporosis. Composites Part B: Engineering. 2023;255:110610.
[8] Jiacan Su* et al. Synthetic biology-based bacterial extracellular vesicles displaying BMP-2 and CXCR4 to ameliorate osteoporosis. Journal of Extracellular Vesicles. 2024;13(4):e12429.
[9] Jiacan Su* et al. Engineered bacterial extracellular vesicles for central nervous system diseases. Journal of Controlled Release. 2023;364:46-60.
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发