【Nature子刊】新希望!武汉大学付磊团队合成Pt纳米壳,或能治愈心肌梗死!
| 导读 | 在本研究中,团队通过Pt纳米颗粒壳(PtNP壳)在第二个近红外(NIR-II)窗口(1064nm处为73.7%),实现了近乎完美的黑体吸收和高PCE。 |
2024年7月28日, 武汉大学付磊团队团队在期刊《Nature Communications》上发表了题为“Pt nanoshells with a high NIR-II photothermal conversion efficiency mediates multimodal neuromodulation against ventricular arrhythmias”的研究论文。本研究中合成的PtNP壳层,在心肌梗死和相关VAs的非侵入性治疗,以及介入治疗期间防止再灌注损伤方面,具有巨大潜力。

https://www.nature.com/articles/s41467-024-50557-w
研究背景
01
心血管疾病已成为导致死亡的主要原因,急性心肌梗死是最有害的疾病之一。心肌缺血(MI)经常诱发急性室性心律失常(VAs),阻碍了急性心肌梗死的及时有效治疗。此外,传统的心肌梗死介入手术,无法规避伴随的心肌再灌注损伤和相关的VAs。交感神经抑制或副交感神经激活,已被证明可以稳定心脏电生理学,预防心肌梗死,并降低VA的发病率。
近年来,多项研究表明,光激活的纳米换能器,可以诱导局部加热效应,导致神经的激活或抑制。考虑到神经反应的急性性质,需要一种具有快速、准确调节的治疗策略。与第一个近红外(NIR-I,650-900 nm)和可见光窗口中的光相比,第二个近红外窗口(NIR-II,900-1700 nm)中的光减少了组织散射和吸收,并增加了生物组织的最大允许暴露量(MPE)。因此,这使得使用NIR-II光热效应,实现非侵入性和非植入式神经调控,成为可能。
在本研究中,团队合成了一种近黑体NIR-II Pt纳米颗粒壳(PtNP-shell),用于防止伴随干预的MI和心肌再灌注损伤。团队以液态金属纳米颗粒为模板,通过简单的电偶联取代反应,合成了PtNP壳层,其具有表面孔隙和中空结构,利用PtNP-shell介导的局部加热效应,实现了快速、高效、精确的多模态自主神经调控。具体来说,副交感神经激活和交感神经抑制,分别通过激活TRPV1(41.0–42.9 °C)和TREK1(45.0–46.9 °C)通道来实现。PtNP-shell介导的光热自主神经调控,分别在心肌缺血再灌注(I/R)损伤模型和MI模型中,有效稳定心脏电生理学并降低VAs发病率。
研究进展
02
PtNP-壳光热抑制LSG,
可改善心肌梗死并减少相关的VAs
为了探究PtNP-壳光热效应,对减少MI诱导的VAs发生的影响,团队采用NIR-II光,使LSG达到约46.0 °C的目标温度,然后才结扎LAD冠状动脉。在NIR-II激光照射下,与对照组相比,PtNP壳组的VTs或VF发生率显著降低(16%对50%)然而,两组在VTs数量和持续时间方面,没有显著差异。此外,VA诱导性检测表明,用PtNP-shell进行光热神经调控后,VA评分下降(1.50 ± 0.76 vs. 4.83 ± 1.14,P < 0.05),有效保护心脏。PtNP-壳光热抑制LSG,对心室电生理指标ERP的保护作用与激活NG相似。VF阈值高于对照组(24.33 ± 4.24 vs. 12.33 ± 3.16,P < 0.05)。LSG的光抑制与NG激活后的心率变异性,遵循相同的趋势。这些结果表明,PtNP壳通过调节自主神经系统,特别是通过减少交感神经活动和增强副交感神经张力,来防止心脏损伤并减少VAs。
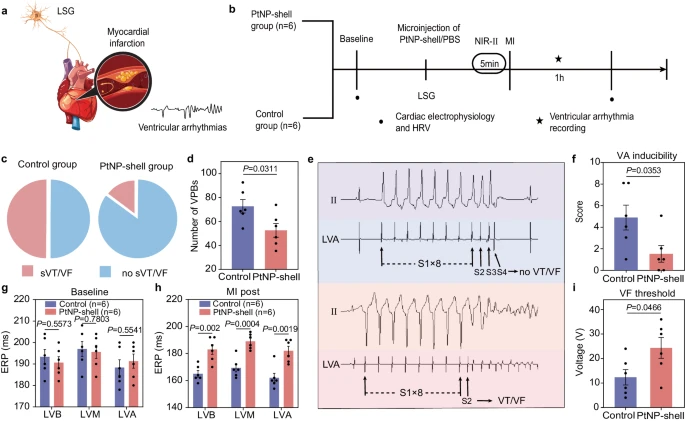
PtNP-壳光热抑制交感神经系统,可改善心肌梗死相关的VAs。
PtNP-shell在转化应用中的生物安全性
为了验证PtNP壳光热调节对自主神经系统的生物相容性,团队对LSG和NG组织进行了快速切除,然后进行苏木精和伊红(H&E)染色和末端脱氧核苷酸转移酶(TdT)dUTP缺口末端标记(TUNEL)检测。H&E和TUNEL染色,未发现NG和LSG的PtNP壳组和对照组,有任何神经元损伤的迹象,表明PtNP壳的神经调控是可重复的。同时,为了进一步研究PtNP壳的长期生物安全性,显微注射200μl PtNP壳(50 μg mL−1或PBS分别给予狗的神经节和大鼠的尾静脉。随访30天后,未发现神经节或主要器官(包括心脏、肝脏、脾脏、肺和肾脏)有明显损伤。血液生化分析表明,没有肝毒性、肾毒性和炎症反应的诱导。这些结果明确证明了,PtNP壳具有优异的生物相容性和长期的生物安全性。
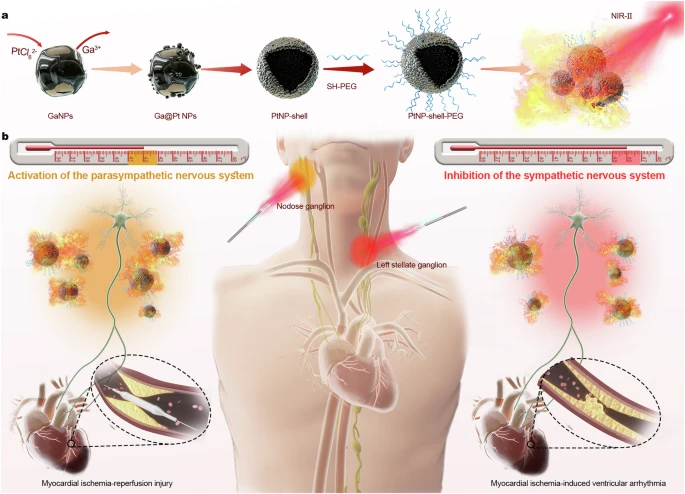
PtNP壳的合成步骤和介导精确光热效,应对抗室性心律失常的概念。
研究结论
03
本研究中合成的PtNP壳层,表现出近乎完美的黑体吸收特性,使其成为一种高效的吸收体,在NIR-II窗口中具有高PCE(1064 nm处为73.7%)。此外,PtNP壳激活诱导的局部加热,可有效触发温度敏感离子通道TRPV1和TREK1,从而能够精确、有效地调节自主神经。这种创新方法在心肌梗死和相关VAs的非侵入性治疗,以及介入治疗期间防止再灌注损伤方面,具有巨大潜力。
心脏交感神经去神经支配术,是一种针对自主神经节治疗难治性室性心律失常的临床程序。在本研究中,团队验证了PtNP-壳光热神经调控策略,在急性心肌梗死和急性再灌注损伤模型中,减轻室性心律失常发生率的保护效果。然而,科学界需要通过实验(例如,评估心脏功能和梗死区域)进行进一步评估,以确定该策略在慢性心肌损伤模型中的保护潜力。
此外,在最大允许暴露(MPE)范围内,可以忽略光造成的最小组织损伤,使其成为对生物体最安全的干预措施之一。光和组织之间的相互作用是错综复杂的,进一步的研究,可以帮助科学界选择更合适的波长,以在MPE范围内实现更深的穿透。利用PtNP壳几乎无可挑剔的黑体吸收和超声引导显微注射技术,可以开发远程和精确的神经调控策略,有望对MI和再灌注损伤相关的VAs提供非侵入性保护。同时,利用神经节周围血管的存在,为最大限度地减少光子在组织内的传播,提供了机会。因此,在介入治疗期间,通过血管途径在神经节附近,通过NIR-II纤进行光热调制,成为直接临床转化的有前途的途径。由于自主神经的广泛分布和神经调节的普遍性,该方法的意义超越了VAs,因为它对难治性高血压和稳定型动脉粥样硬化等慢性疾病,表现出广泛的治疗前景。
参考资料:
1.Virani, S. S. et al. Heart disease and stroke statistics—2020 update: a report from the American Heart Association. Circulation 141, E139–E596 (2020).
2.Trayanova, N. A. Learning for prevention of sudden cardiac death. Circ. Res. 128, 185–187 (2021).
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发