【Nature子刊】中日友好医院肖诚团队:N6-甲基腺苷在肿瘤新生血管形成中的作用
| 导读 | 本文探讨了m6A影响肿瘤新生血管的形成,重点关注其对血管生成和血管生成模拟(VM)的影响。 |
2024年8月5日,中日友好医院肖诚团队在期刊《Cell Death & Disease》上发表了题为“Role of N6-methyladenosine in tumor neovascularization”的研究论文。本文阐明了肿瘤新生血管形成的潜在机制,m6A在抗血管生成治疗中的作用,并为靶向肿瘤,提供了新的见解。

https://www.nature.com/articles/s41419-024-06931-z
研究背景
01
肿瘤新生血管形成,可确保获得肿瘤持续生长所需的充足氧气和营养物质。“血管生成开关”的诱导,取决于血管生成因子和抗血管生成因子的平衡,是肿瘤发生的限速步骤,触发肿瘤呈指数增长。 新生血管形成,被认为是癌症的标志,是肿瘤增殖、侵袭和转移不可或缺的因素。因此,靶向肿瘤新生血管形成,已成为癌症治疗的重要组成部分。现有的抗血管生成策略,主要集中在血管内皮生长因子(VEGF)或VEGF受体(VEGFR)信号通路上。
最近,研究人员提出,非突变表观遗传重编程,有助于肿瘤获得标志性能力。 表观遗传学是指对不涉及DNA序列变化的可遗传改变的研究,包括DNA和RNA甲基化、核小体重塑和组蛋白修饰。科学界已鉴定出170多种RNA修饰,包括N6-甲基腺苷(m6A)、5-甲基胞嘧啶(m5C)、N7-甲基鸟苷和N1-甲基腺苷。其中最普遍的RNA修饰是m6A,于1974年首次描述,在腺苷的第6个氮原子处发生RNA甲基化。它在重塑肿瘤微环境(TME)、调节癌症代谢和促进癌变方面,发挥着重要作用。
在本文中,团队旨在探讨m6A在肿瘤新生血管形成中的调节作用,提供了对其在癌症治疗中的重要性的全面理解。这篇综述介绍了m6A在多种新生血管形成模式和相关信号通路中的多样化作用。此外,团队简明扼要地概述了其对血管免疫串扰的贡献。最后,团队讨论了m6A的发展现状及其潜在的临床应用。
研究进展
02
m6A介导的免疫细胞对肿瘤新生血管形成的影响
肿瘤相关巨噬细胞(tumor-associated macrophages, TAM)表现出不同的M1或M2表型,其中M1样TAMs促进炎症并抑制血管生成,而M2样TAMs表现出促进血管生成的免疫抑制表型。ALKBH5促进神经胶质瘤中M2样TAMs的募集。在胰腺癌中,lncPACERR通过IGF2BP2促进M2样TAMs极化,从而驱动肿瘤进展。DCs对肿瘤血管生成的影响,取决于它们的成熟状态。成熟DCs(mDCs)抑制肿瘤血管生成,而未成熟DCs(iDCs)表现出促血管生成作用。 在GC中,YTHDF1缺失会增加mDCs募集,表明YTHDF1具有促血管生成作用。此外,其他免疫抑制细胞如MDSCs、Tregs和表达Tie2的巨噬细胞也有助于肿瘤血管生成。在CRC中,METTL3募集MDSC并促进肿瘤生长。一致地,在宫颈癌中,METTL3与CD33 MDSC呈正相关,并预测不良预后。相反,在ICC中,ALKBH5减少MDSC样细胞积累,增强PD-L1表达,从而促进免疫浸润。
考虑到适应性免疫,CD8 CTLs释放IFN-γ以使血管正常化,而辅助性T(Th)细胞(包括Th1、Th2和Th17亚群)通过释放趋化因子和激活M2样TAMs,积极参与血管生成。在CRC和黑色素瘤中,METTL3和METTL14缺失可增加CD8 CTL水平,并增强对抗PD1治疗的反应。同样,GC中YTHDF1的沉默可增加CD8 CTL和mDCs的比例,从而恢复对免疫治疗的敏感性。
m6A的基本函数调节因子及其对肿瘤新生血管形成的影响。
m6A癌症治疗中的甲基化
最近的研究表明,靶向RNA甲基化调节因子的抑制剂,在癌症治疗中具有潜力。例如,SAH和广谱2-OG加氧酶抑制剂IOX1分别通过靶向METTL3-METTL14和ALKBH5,来抑制癌症的发展。此外,FB23-2、FG-2216/IOX3、Rhein、Entacapone和甲氯芬那酸等抑制剂抑制FTO活性,阻止AML和GBM的自我更新和致瘤特性。在小鼠异种移植模型中,FTO抑制导致肿瘤生长减少和生存期延长。
STC-15作为靶向METTL3的口服小分子抑制剂,是首创的RNA修饰抑制剂。2022年11月,该药进入I期临床试验,代表首个进入临床开发的RNA甲基转移酶抑制剂。STC-15已被证明具有抑制AML或通过抗癌免疫反应抑制肿瘤生长的功效,为癌症治疗开辟了一条新的途径。
另一个有前途的候选药物是STM2457,这是一种高度选择性的METTL3抑制剂,对其他甲基转移酶的影响最小,表明其作为靶向癌症疗法的潜力。临床前研究表明,STM2457特异性抑制AML中的关键干细胞群,对正常造血功能无显著毒性,促进细胞分化,诱导凋亡,抑制肿瘤生长。
转录后修饰(PTM)已被证明与各种人类疾病有关。RNA 修饰可以通过调节mRNA稳定性、翻译效率和其他RNA代谢过程,来成为监测癌症进展的潜在生物标志物。不同癌症类型的不同修饰模式,会影响肿瘤细胞的增殖、凋亡、侵袭性和代谢活动等行为,这使其成为癌症研究中的重要指标。
临床上,检测m6A通常需要高通量测序(如MeRIP-seq)和特异性免疫沉淀技术。作为生物标志物,m6A修饰的优点是动态反映肿瘤细胞内的生物学变化,允许通过非侵入性样本(如血液)实时监测肿瘤进展和治疗反应。总体而言,RNA修饰作为潜在癌症生物标志物的研究仍处于早期阶段,需要进一步研究,以克服当前的技术障碍,并提高其临床准确性和可行性。
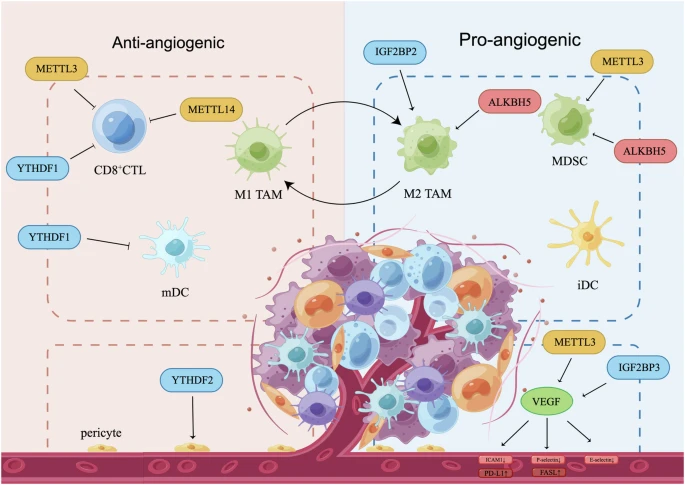
m6A血管免疫串扰中的调节因子。
研究结论
03
这篇综述强调了m6A的重要作用,以及肿瘤新生血管形成的改变。团队的目标是探索m6A如何影响各种新生血管形成模式,及其与TME的多种信号通路和组件的相互作用。
越来越多的证据表明,m6A广泛参与抗血管生成抵抗。具体来说,在HCC和RCC中,两者都以高血管密度为特征。增加m6A水平,有助于提高肝细胞癌患者对索拉非尼、阿帕替尼和乐伐替尼的耐药性。在常氧条件下,METTL3通过Wnt/β-catenin途径增加对索拉非尼和乐伐替尼的耐药性,而WTAP在缺氧条件下促进乐伐替尼耐药性。敲低METTL14通过上调肝细胞核因子3γ(HNF3γ) ,来恢复对索拉非尼的敏感性。在RCC中,下调METTL14通过降低TRAF1表达,来增强对舒尼替尼的敏感性。YTHDC1通过抑制组蛋白去乙酰酶2(HDAC2),增加对舒尼替尼的敏感性。相反,在帕唑帕尼耐药的cRCC中,YTHDF2无法识别lncIGFL2AS1的降解,从而促进耐药性。这些发现表明,将m6A作为目标,有望提供一种新的抗血管生成治疗方法。m6A在肿瘤新生血管形成中的调节作用至关重要,需要进一步研究,以制定可能的治疗策略。科学界需要更多的研究来充分了解其临床潜力,特别是它与各种途径和免疫细胞的相互作用。尽管针对m6A作为一种抑制剂的研究有限,越来越多的证据表明,这种方法有治疗肿瘤的潜力。
参考资料:
1.Potente M, Gerhardt H, Carmeliet P. Basic and therapeutic aspects of angiogenesis. Cell. 2011;146:873–87.
2.Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285:1182–6.
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发