新型生物标志物!南方医科大学发文:揭示血脑屏障修复治疗靶向新策略
| 导读 | 蛛网膜下腔出血(SAH)严重损害血脑屏障(BBB)并损害患者康复。 |
8月7日,南方医科大学研究团队在期刊《Cell Death&Disease》上发表了研究论文,题为“Hepcidin depending on astrocytic NEO1 ameliorates blood-brain barrier dysfunction after subarachnoid hemorrhage”,本研究阐明了星形胶质细胞Neogenin-1 (NEO1)在SAH后血脑屏障完整性中的关键作用,并研究了Hepcidin在NEO1介导的铁稳态破坏中对内皮细胞(EC)功能的调节作用。SAH患者脑脊液(CSF)的蛋白质组学分析显示NEO1表达显著降低,确定其是血脑屏障完整性的关键因素。111个CSF蛋白在SAH早期(1-3天)显著减少,NEO1蛋白的变化最为显著。这种失调与较差的患者预后有关, 实验模型进一步强调了NEO1的重要性。本研究结果强调了星形细胞信号传导和内皮功能在SAH病理生理中的复杂相互作用。通过透射电镜和PECAM-1免疫染色证实,星形胶质细胞NEO1的缺失导致EC增殖增加和血脑屏障结构改变,表明受影响皮层血管密度增加。Hepcidin治疗有效地逆转了NEO1-cKO小鼠和SAH模型的EC功能障碍和血脑屏障破坏,突出了Hepcidin作为一种促进SAH后恢复和改善预后的治疗药物的潜力。

https://www.nature.com/articles/s41419-024-06909-x#Sec9
背景知识
01
蛛网膜下腔出血(SAH)是一种神经系统疾病,其特点是由于脑动脉瘤破裂而导致的高死亡率和高发病率。大约50%的幸存者有严重的神经损伤。尽管临床干预取得了进展,但脑水肿是神经功能缺损和不良预后的主要原因,其有效管理仍然难以捉摸。脑水肿在综合入院参数分析中被认为是唯一可接受治疗干预的预后因素,强调了在这一领域进行有针对性研究的必要性。SAH后脑水肿发病机制的核心是血脑屏障(BBB)的破坏,血脑屏障是维持神经元稳态所必需的复杂的多细胞血管结构。蛛网膜下腔出血后任何血脑屏障成分的破坏都会导致神经炎症和神经变性。鉴于SAH模型小鼠在颈外动脉和颈总动脉分叉处表现出出血的倾向,对血脑屏障破坏的研究主要集中在邻近的颞基底皮质。然而,该区域的生理功能并不能完全解释该模型中观察到的神经缺陷。
至关重要的是,一项采用表观扩散系数的研究确定了SAH患者普遍存在的脑水肿,强调有必要探索颞基底皮质以外的血脑屏障完整性,特别是在SAH后的顶叶皮质。由内皮细胞(ECs)形成的脑血管是血脑屏障的核心成分。研究强调,在SAH后24小时,颞基底皮质内的脑血管(BV)密度显著降低。星形胶质细胞的端足包裹着内皮细胞,在维持血脑屏障完整性方面发挥着重要作用。星形胶质细胞的保存已被证明可以预防SAH后血脑屏障的进一步破坏,尽管支撑这种保护作用的确切机制仍有待阐明。越来越多的证据表明,星形胶质细胞可能通过可溶性因子的分泌来调节脑内皮细胞的命运,但星形胶质细胞对SAH后内皮细胞的影响仍未被研究。
Hepcidin减轻NEO1-cKO小鼠和SAH模型的血脑屏障破坏
02
为了研究Hepcidin对内皮细胞(ECs)的影响,研究人员首先通过NEO1敲除星形胶质细胞(astrocytes)和EC共培养的迁移实验确定了ECs和CM中Hepcidin的浓度。在涉及ECs和NEO1敲除(KO)星形胶质细胞条件培养基(CM)的共培养Transwell实验中,根据先前在体外的研究结果,将600 nM、800 nM和1000 nM浓度的Hepcidin引入共培养介质中。研究人员观察到,Hepcidin的施用导致EC铁含量增加,800 nM和1000 nM组之间的铁储存蛋白(FTH和FTL)没有显著差异。此外,研究人员研究了800 nMHepcidin对EC增殖的影响,发现与NEO1 KO星形胶质细胞CM共培养时,EdU+ MBMECs减少。Hepcidin还减少了EC对NEO1 KO星形胶质细胞CM的迁移反应,并通过IF分析显著减轻了CM从NEO1 KO星形胶质细胞诱导的MBMECs中囊泡的增加。值得注意的是,Hepcidin改善了与NEO1 KO星形胶质细胞CM共培养的MBMEC单层的通透性。
为了确定是否可以通过注射Hepcidin来修复NEO1-cKO小鼠的BBB损伤,研究人员将Hepcidin注射到NEO1-cKO小鼠的左侧皮层,并向对侧皮层注射PBS作为对照。免疫染色显示,与对照侧相比,Hepcidin治疗的皮层中BV密度和3 kDa脱乙酰壳多糖的渗漏显著降低。此外,Hepcidin治疗的皮层中,皮层EC腔泡减少,Hepcidin逆转了CM导致的NEO1 KO星形胶质细胞铁含量的下降,这表明Hepcidin能够有效减少异常BV血管生成并修复NEO1-cKO皮层的BBB损伤。
为了测试Hepcidin对SAH后皮质BVs的影响,研究人员将Hepcidin注入出血侧的顶叶皮层。在SAH后7天的检查中发现,与对照组相比,Hepcidin治疗增加了皮质ECs中的FTH和FTL水平,并观察到相应的FPN表达调整。3 kDa脱氧糖核糖核酸(DNA)探针实验进一步证实了Hepcidin对BBB完整性的积极影响,显示与对照组相比,Hepcidin处理的皮质中BV密度降低,脱氧糖核糖核酸泄漏减少。此外,Hepcidin治疗后皮质ECs中的窗孔和小窝明显减少。综上所述,这些结果表明Hepcidin可以减轻SAH后皮质BBB的破坏。
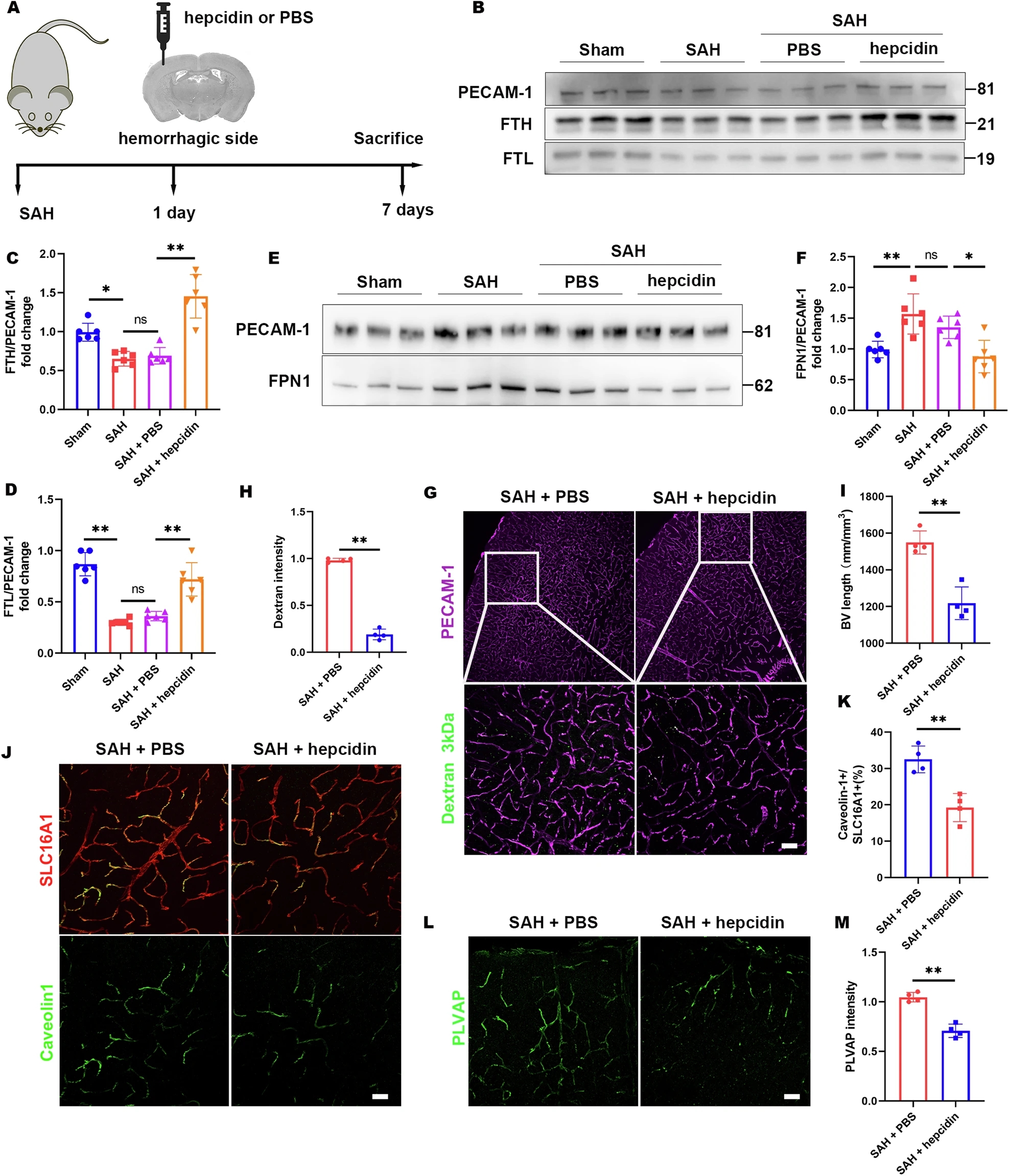
Hepcidin改善SAH模型的皮质血管增加和BBB渗漏
研究小结
03
在这项研究中,研究人员确定脑脊液Neo1是SAH患者不良预后的生物标志物,将血脑屏障破坏与星形细胞Neo1介导的内皮功能障碍联系起来。研究人员阐明星形细胞Neo1如何通过Hepcidin影响内皮细胞的铁储存和功能,强调Hepcidin在维持血脑屏障完整性中的保护作用。这凸显了靶向Hepcidin作为SAH后血脑屏障修复治疗策略的潜力。(转化医学网360zhyx.com)
【参考资料】
https://www.nature.com/articles/s41419-024-06909-x#Sec9
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发