同仁医院杨金奎团队:KCNH2是治疗糖尿病和肥胖症的有前途的新靶点
| 导读 | 在本研究中,团队发现了KCNH2钾通道在调节肠促胰岛素分泌中的关键作用,推进了科学界对肠促胰岛素调节的理解,为潜在的肠促胰岛素促分泌素疗法治疗糖尿病和肥胖症铺平了道路。 |
2024年8月12日,首都医科大学附属同仁医院杨金奎团队在期刊《Signal Transduction and Targeted Therapy》上发表了题为“Potassium voltage-gated channel subfamily H member 2 (KCNH2) is a promising target for incretin secretagogue therapies”的研究论文。本研究表明了KCNH2通道在调节EEC分泌肠促胰岛素方面的关键作用。考虑到肠促胰岛素在食欲控制和葡萄糖代谢中的关键作用,KCNH2成为治疗肥胖和糖尿病的一个有前途的新靶点。

https://www.nature.com/articles/s41392-024-01923-z
研究介绍
01
胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素肽(GIP)分别来源于肠内分泌L细胞和K细胞,通过增强胰岛β细胞分泌葡萄糖依赖性胰岛素,作为肠促胰岛素激素发挥关键作用。K细胞位于十二指肠中,而L细胞位于回肠和结肠中,它们的顶端表面直接暴露在肠腔中,使它们能够感知管腔营养物质,并释放肠促胰岛素。肠促胰岛素效应占葡萄糖摄入后正常胰岛素释放的50-70%,强调了GLP-1和GIP的重要性。在患有2型糖尿病(T2D)和葡萄糖耐受不良的个体中观察到GLP-1和GIP水平降低,外源性GLP-1补充剂已被证明可有效促进T2D患者的胰岛素分泌。GLP-1受体激动剂(GLP-1RA)用于T2D和肥胖症的开发,已显示出心肾益处。进行中的试验,正在探索它们对代谢性肝病、外周动脉疾病、帕金森氏症和阿尔茨海默氏症的疗效。基于GLP-1的药物,成功导致了具有独特特征的新分子,例如 tirzepatide,一种GIP-GLP-1受体激动剂。maritide等研究药物可阻断GIP并激活GLP-1受体,而retatrutide和survodutide则靶向胰高血糖素和GLP-1受体。
为了在治疗中利用自然的内源性肠促胰岛素分泌,了解驱动肠内分泌细胞(EEC)释放激素的分子机制,对于动员内源性肠促胰岛素至关重要。尽管驱动肠内分泌细胞分泌肠促胰岛素的细胞内机制仍然知之甚少,但它们可能与胰腺β细胞中的电活动调节机制相似,表明其存在保守的分泌通路。在肠内分泌细胞中,由葡萄糖转运蛋白介导的葡萄糖,摄取诱导细胞膜去极化和钙内流,触发肠促胰岛素释放。调节激素分泌的钾通道涉及电压门控钾离子通道(Kv)家族(复极化),以及ATP敏感的钾离子通道(KATP酸促成酸酯)去极化。Kv通道对于可兴奋组织中的动作电位复极化至关重要,在激活时促进钾外排,导致膜复极化或超极化。Kv通道的功能障碍或阻塞,可以通过在复极化过程中阻碍钾离子外排,来延长动作电位持续时间(APD),从而调节激素分泌。
KCNH2,也称为Kv11.1或hERG1,代表了Kv通道家族的重要成员。KCNH2在包括肠道K细胞和L细胞在内的各种组织中表达,作为其阻滞剂的副作用,它与低血糖症的关联,表明在调节血糖稳态方面具有潜在作用。
本研究利用体内小鼠模型和体外肠内分泌细胞系,探讨了KCNH2的作用和机制,揭示了小鼠中KCNH2在产生GIP的K细胞和产生GLP-1的L细胞中的表达。本研究提供了一种独特的机制,可以促进肠内分泌细胞分泌肠促胰岛素,并为治疗糖尿病和肥胖症等代谢疾病提供增强内源性肠促胰岛素分泌的新策略。
研究进展
02
KCNH2敲低抑制Kv电流,延长APD,增加Ca2+浓度
为了评估KCNH2通道的敲除是否会影响STC-1细胞的电生理活性,团队采用siRNA来抑制这些细胞中KCNH2的表达。Kv通道对于可兴奋细胞中的动作电位复极化至关重要,它们的阻断或功能丧失可导致复极化过程中钾离子流出减少,从而延长APD。由于KCNH2是电压门控钾通道家族的成员,因此,团队记录了全电池总Kv电流。分析结果表明,用KCNH2 siRNA处理的STC-1细胞的Kv电流显著低于对照细胞,在较高电压下降低更明显 。
为了确定KCNH2敲低对STC-1细胞中APD的影响,团队在电流钳模式下诱导电动作电位。研究结果表明,与对照细胞相比,KCNH2 siRNA处理的细胞的动作电位复极化延长。然而,两组间动作电位振幅和静息膜电位差异无统计学意义。
为了进一步研究KCNH2通道在钙稳态中的功能,团队使用siRNA抑制STC-1细胞中KCNH2的表达,并检测了[Ca2+]i 至高血糖和刺激剂,包括毛喉素加 IBMX。与对照组(siRNA-NC)相比,团队观察到刺激后KCNH2 siRNA处理的STC-1细胞中的细胞内钙浓度增加。
为了更好地了解钙稳态与肠促胰岛素释放之间的关系,团队使用钙螯合剂EGTA来检查STC-1细胞中葡萄糖刺激分泌的肠促胰岛素分泌。结果表明,KCNH2下调的STC-1在葡萄糖刺激后显著增加GIP和GLP-1分泌。然而,在KCNH2下调和对照STC-1细胞中添加EGTA后,GIP和GLP-1的分泌增加减少。这些结果表明,KCNH2下调或控制STC-1细胞中葡萄糖刺激的肠促胰岛素分泌是钙依赖性的。
综上所述,KCNH2通道调节反极化Kv电流,其减少导致APD延长并增强[Ca2+]i在葡萄糖刺激的STC-1细胞中。
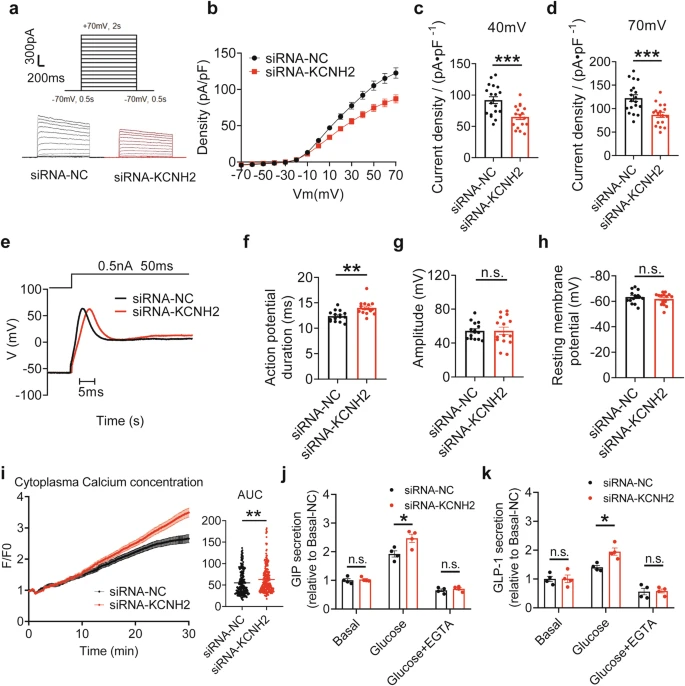
KCNH2敲低抑制Kv电流,延长APD,增加Ca2+在肠内分泌细胞中的浓度。a 用siRNA-NC或siRNA-KCNH2处理的STC-1细胞的代表性Kv电流。将电池在−70 mV的电压下保持2秒,然后以10 mV的步长去极化至70mV。b–d STC-1细胞中Kv电流(b)和+40 mV(c)和+70 mV(d) 时的平均Kv电流密度的稳态电流-电压(I-V)曲线摘要(siRNA-NC, n = 19; siRNA-KCNH2, n = 17)。e 用siRNA-NC或siRNA-KCNH2处理的STC-1细胞在电流钳模式下捕获的代表性动作电位。f–h STC-1细胞中动作电位持续时间(f)、振幅(g)和静息膜电位(h) 的总结(siRNA-NC,n = 15 ;siRNA-KCNH2,n = 15 )。i 使用2μM Fluo4-AM检测细胞内钙浓度。总共31分钟,每5秒获得一次读数,在用10mM 葡萄糖和10μM毛喉素加IBMX刺激前60秒和刺激后30分钟记录。用加扰siRNA和KCNH2 siRNA处理的STC-1细胞获得了荧光变化比 (F/F0)。STC-1细胞曲线下面积(AUC)汇总(siRNA-NC,n = 232 ;siRNA-KCNH2,n = 244 )。j, k STC-1细胞在Krebs-Ringer碳酸氢盐缓冲液(KRBB)或补充有10mM EGTA的KRBB中孵育30分钟,然后将10 mM葡萄糖或10 mM葡萄糖补充有10mM EGTA或0 mM葡萄糖(基础)KRBB再孵育2小时。siRNA-NC和siRNA-KCNH2 STC-1细胞中的GIP分泌(j)和GLP-1分泌(k)(n= 每组 4 次重复)。
Dofetilide在体内和体外EEC中促进小鼠的肠促胰岛素分泌
团队使用KCNH2特异性抑制剂多非利特,来探索其对肠促胰岛素分泌的影响。多非利特是一种相对较新的III类抗心律失常药物,可特异性抑制心脏离子通道中延迟整流钾电流的快速分量。它在将心房颤动或扑动转化为窦性心律方面,显示出显著的功效。结果显示,多非利特在葡萄糖刺激后增强了STC-1细胞的细胞内钙水平,表明阻断KCNH2可提高细胞内钙浓度,从而进一步促进STC-1细胞分泌肠促胰岛素。
团队从小鼠的十二指肠和回肠中提取原代肠上皮细胞,发现多非利特使十二指肠上皮细胞中的GIP分泌增加了30%,使回肠上皮细胞中的GLP-1分泌增加了20%。然而,多非利特对KCNH2 CKO小鼠的肠上皮细胞没有显著影响,既不能促进GIP分泌,也不会促进GLP-1的分泌。
为了更好地研究多非利特对肠促胰岛素的促进作用,团队对高脂饮食(HFD)诱导的高血糖症的C57BL/6 J小鼠给予多非利特或载体。口服葡萄糖攻击后,多非利特显著降低了HFD喂养小鼠的血糖水平,并增加了GLP-1、GIP和胰岛素水平。这些结果表明,多非利特通过阻断KCNH2增加细胞内钙浓度,从而增加肠促胰岛素分泌,并改善葡萄糖稳态。
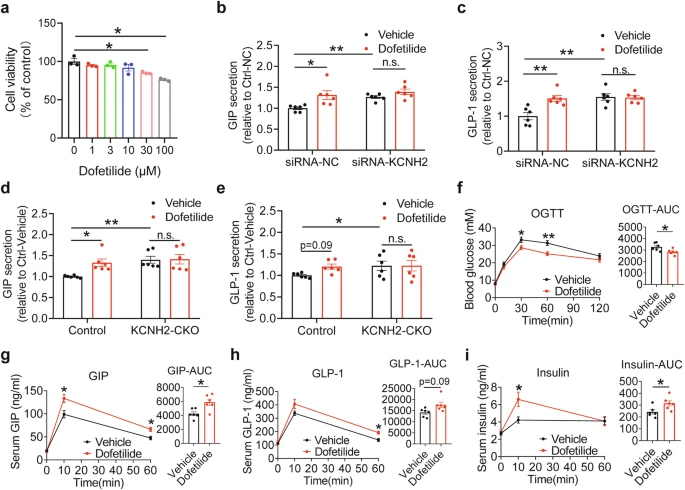
Dofetilide在体内和体外EEC中促进小鼠的肠促胰岛素分泌。a STC-1细胞与不同浓度的多非利特孵育2小时的活力(每组n=3次重复)。b, c 用50nM加扰siRNA(siRNA-NC)或抗KCNH2的siRNA(siRNA-KCNH2)转染肠内分泌细胞系(STC-1细胞)48小时。将STC-1细胞在Krebs-Ringer碳酸氢盐缓冲液(KRBB)中孵育30分钟,然后用10mM 葡萄糖 KRBB加载体或10mM葡萄糖KRBB补充10μM多非利特再孵育2小时。葡萄糖诱导的GIP分泌(b)和GLP-1分泌(c)(n=每组6次重复)。d,e PIEC在KRBB中培养30分钟,然后10mM葡萄糖KRBB加载体或10mM葡萄糖KRBB补充10μM多非利特处理另外2小时。 葡萄糖诱导的GIP分泌(d)和GLP-1分泌(e)(每组n=6次重复)。f-i HFD喂养(第8周开始,持续6-8周)C57BL/6J 口服给药5mg/kg多非利特或载体,然后加入5g/kg葡萄糖用于OGTT。血糖水平和AUC(f)、血清GIP水平和AUC(g)、血清GLP-1水平和AUC(h)以及血清胰岛素水平和AUC(i)(载体,n=6;多非利特,n=6)。
研究结论
03
本研究首次阐明了KCNH2钾通道在调节肠内分泌细胞分泌肠促胰岛素激素中的作用和机制。KCNH2缺乏会降低Kv电流,延长肠内分泌细胞的复极化。这种长时间的复极化会增加Ca2+内流,提高细胞内钙2+水平,并触发肠促胰岛素分泌增加。最后,KCNH2特异性抑制剂dofetilide通过阻断KCNH2促进肠促胰岛素分泌,导致细胞内钙浓度增加,从而进一步增强胰岛素分泌。这些发现强调了KCNH2作为治疗肥胖和糖尿病的有前途的新靶点的潜力。
研究表明,除了KATP酸促成酸酯和钙通道,Kv通道在EECs中肠促胰岛素分泌中,起着至关重要的作用。肠内分泌细胞中KCNH2缺失,对肠促胰岛素分泌的影响,不能归因于肠促胰岛素表达、合成和降解水平的改变,因为GIP和GLP-1的含量,以及PCSK1/PCSK2和DPP-4的表达在CKO和对照小鼠中相似。这些发现表明,KCNH2在作用电位复极化中发挥作用,并对EECs中肠促胰岛素分泌产生调节控制。
本研究强调了KCNH2对肠促胰岛素分泌的独特调节作用,特别是GIP优于GLP-1,这在涉及CKO小鼠的体内和体外实验中都很明显。团队比较了KCNH2在肠道不同EECs中的表达,发现KCNH2在K细胞(GIP产生者)中的表达水平高于L细胞(GLP-1产生者),这表明KCNH2在十二指肠K细胞GIP分泌中的作用,可能比在回肠L细胞GLP-1分泌中发挥更关键的作用。
由于KCNH2抑制剂的心脏毒性可能导致长QT综合征,团队提出了几种策略来应对这一挑战。首先,团队建议改变已知KCNH2抑制剂的化学结构,使其在循环中不易吸收。其次,利用冷冻电子显微镜等技术,对不同器官(包括心脏、胰岛和肠道)KCNH2钾通道的结构差异,进行全面分析。通过采用这些策略,科学界可以利用KCNH2抑制在代谢疾病管理中的治疗潜力,同时减轻相关的安全问题,最终为有效和安全的治疗方案提供新的途径。
参考资料:
1.Baggio, L. L. & Drucker, D. J. Biology of incretins: GLP-1 and GIP. Gastroenterology 132, 2131–2157, (2007).
2.Ezcurra, M., Reimann, F., Gribble, F. M. & Emery, E. Molecular mechanisms of incretin hormone secretion. Curr. Opin. Pharmacol. 13, 922–927, (2013).
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发