新选择!杭州医学院合作发文:肝癌患者新的生物标记物和靶点
| 导读 | 仑伐替尼是一种用于肝细胞癌(HCC)一线治疗的靶向药物。迫切需要对HCC对仑伐替尼的耐药机制有更深入的了解。 |
9月19日,杭州医学院与浙江省肿瘤医院研究人员合作在期刊《Signal Transduction and Targeted Therapy》上发表了研究论文,题为“The p-MYH9/USP22/HIF-1α axis promotes lenvatinib resistance and cancer stemness in hepatocellular carcinoma”,本研究中,研究人员旨在分析仑伐替尼耐药(LR)的潜在机制,并提供有效的治疗策略。研究人员建立了获得性LR的HCC模型。通过细胞计数、迁移、自我更新能力、化疗耐药和干性基因表达检测肝癌细胞的干性。研究人员采用RNA测序、免疫共沉淀、质谱分析和泛素化分析等分子和生化策略来探索潜在的机制,并使用患者来源的HCC模型和患者的HCC样本来证明临床意义。研究人员发现,缺氧诱导因子-1α (HIF-1α)通路激活导致的肿瘤干性增加是HCC获得性LR的原因。在仑伐替尼耐药的HCC中,磷酸化的非肌性肌球蛋白重链9 (MYH9), p-MYH9 (Ser1943)可以招募泛素特异性蛋白酶22 (USP22)去泛素化并稳定HIF-1α。临床上,p-MYH9 (Ser1943)在HCC样本中表达上调,与不良预后和LR相关。一种酪蛋白激酶-2 (CK2)抑制剂和一种USP22抑制剂在体内和体外均有效逆转LR。因此,p-MYH9 (Ser1943)/USP22/HIF-1α轴对LR和癌症干性至关重要。p-MYH9 (Ser1943)、USP22和HIF-1α可能成为HCC LR的新的生物标志物和靶点。

https://www.nature.com/articles/s41392-024-01963-5#Sec10
背景知识
01
肝癌是最常见的恶性肿瘤之一,在所有癌症相关死亡原因中排名第三。肝细胞癌(HCC)约占原发性肝癌病例的90%。尽管加强了HCC的监测,但患者确诊时通常处于中晚期,失去了根治性手术的机会。射频消融(radiofrequency ablation, RFA)、经动脉化疗栓塞(transarterial chemoembolization, TACE)和肝动脉灌注化疗(hepatic arterial infusion chemotherapy, HAIC)等介入治疗是通过侵入性操作阻断肿瘤血供并直接递送化疗药物来破坏肿瘤细胞。系统性治疗改变了晚期HCC的临床管理方式,为缩小肿瘤大小和根治性手术提供了新的机会。仑伐替尼、阿帕替尼和贝伐珠单抗等酪氨酸激酶抑制剂(TKIs)已被证明可抑制肿瘤血管生成,并广泛应用于HCC患者。然而,持续使用最终会导致靶向耐药的出现。
仑伐替尼是一种抑制VEGFR1-3、FGFR1-4、PDGFR-α、KIT和RET的多靶点TKI。在REFLECT研究中,仑伐替尼在总生存期方面不劣于索拉非尼,但在无进展生存期方面优于索拉非尼,为HCC患者提供了另一种有前景的选择。已成为继索拉非尼之后第二种获批的晚期HCC一线治疗药物。既往研究表明,仑伐替尼耐药可能是影响疗效的主要因素。BCL2相互作用蛋白3 (BNIP3)的过度激活可重编程糖酵解以增加HCC的仑伐替尼耐药(LR)。通过对患者来源的肿瘤异种移植类器官(PDOs)的肝癌异质性的详细分析,研究人员发现一个关键分子c-Jun可以通过β-catenin通路促进肝癌和LR的干性。c-Jun抑制剂PKUF-01与仑伐替尼在LR PDOs中具有协同作用。n6 -甲基腺苷读取器YTHDF1通过增加NOTCH mRNA的表达促进PDOs和HCC细胞系的干性和LR。然而,LR的相关机制仍不清楚。研究潜在的分子机制和寻找潜在的靶点是克服LR的关键。
靶向p-MYH9 (Ser1943)可逆转LR并抑制肝癌中的肿瘤干性
02
由于MYH9稳定HIF-1α并促进LR和p-MYH9 (Ser1943)与HIF-1α特异性相互作用,研究人员想知道p-MYH9 (Ser1943)是否可以成为逆转LR和抑制肿瘤干性的有效靶点。研究人员检测11株肝癌细胞株中p-MYH9 (Ser1943)的表达水平,通过CCK-8法计算仑伐替尼对肝癌细胞株的IC50值。p-MYH9 (Ser1943)的表达与仑伐替尼的IC50值呈显著正相关(r = 0.837),提示p-MYH9 (Ser1943)可能在仑伐替尼原发性耐药中发挥重要作用。此外,研究人员构建了患者来源的肝癌模型,包括来自人肝癌组织的患者来源的肿瘤异种移植(PDX)、原代细胞和PDO。根据p-MYH9 (Ser1943)表达水平,低p-MYH9 (Ser1943)表达的PDX模型对仑伐替尼的敏感性显著高于高p-MYH9 (Ser1943)表达的PDX模型。原代肝癌细胞模型显示相似结果。由于类器官是评估干性的一个很好的模型,研究人员也用PDO模型进行了实验。研究结果表明,与p-MYH9 (Ser1943)表达较低的PDO模型相比,p-MYH9 (Ser1943)表达较高的PDO模型显示出更快的扩增。
由于缺乏p-MYH9 (Ser1943)的特异性抑制剂,研究人员筛选了一些既往研究报道的抑制剂。与其他抑制剂相比,酪蛋白激酶2 (CK2)抑制剂CX-4945能有效抑制p-MYH9 (Ser1943)和HIF-1α的表达及HIF-1α的转录活性。功能实验表明,CX-4945抑制肝细胞癌LR细胞的肝球形成,迁移和CSC标志物的mRNA表达。CX-4945联合仑伐替尼具有协同抑制HuH-7-LR、SNU-387-LR细胞和原代肝癌细胞克隆形成和增殖的作用。体内实验进一步表明,CX-4945可增加仑伐替尼对HCC LR细胞的敏感性,并抑制移植瘤的生长,且不良反应可接受。移植瘤免疫组化分析显示,CX-4945组和联合用药组p-MYH9 (Ser1943)和HIF-1α表达显著降低。CX-4945联合仑伐替尼可抑制Ki67的表达。原位肝细胞癌模型的结果也显示出类似的趋势。这些结果表明,CX-4945可以在体内外抑制LR细胞的肿瘤干性,进一步证明了p-MYH9 (Ser1943)介导的HIF-1α稳定性调节了HCC LR细胞的肿瘤干性。
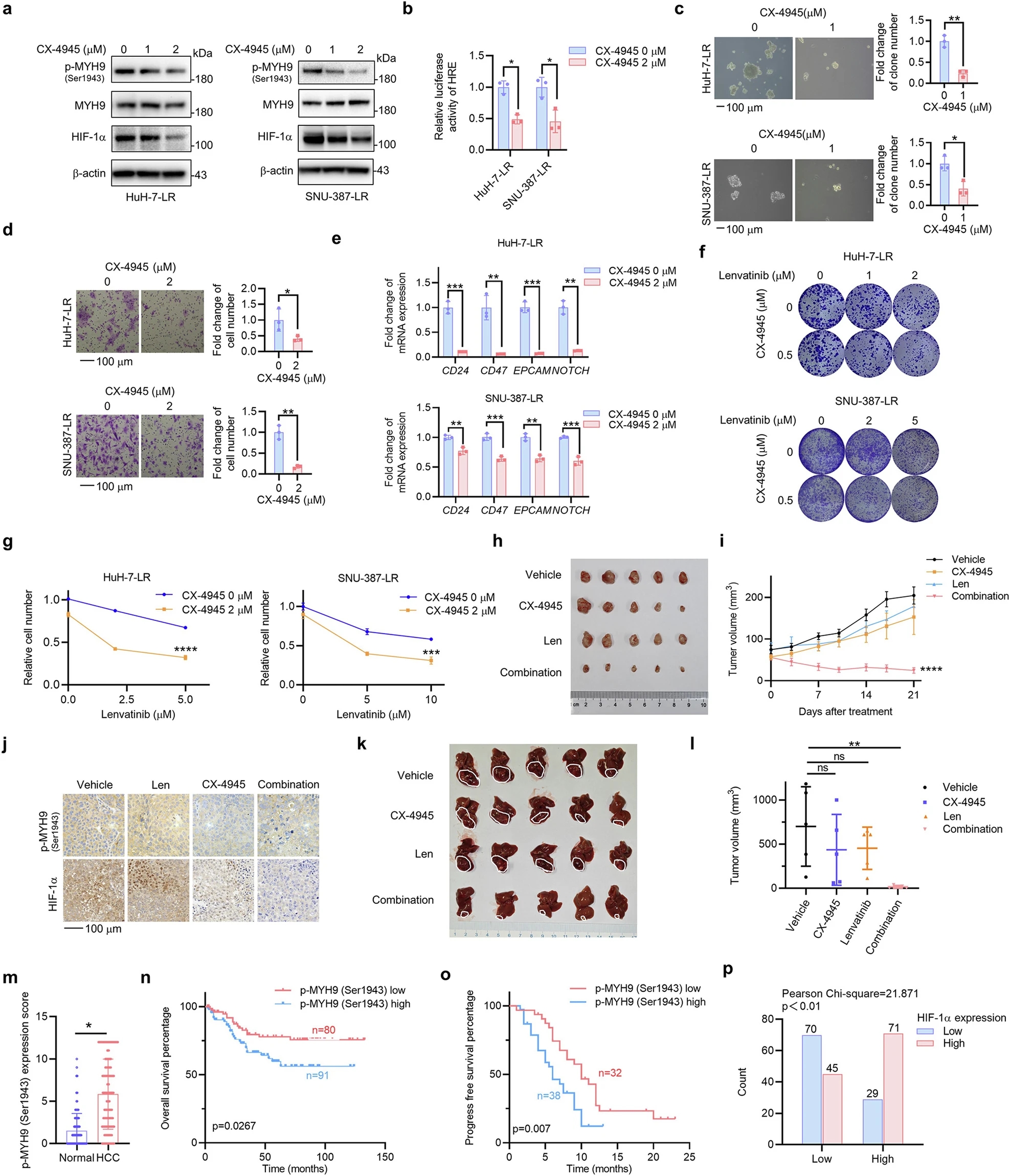
p-MYH9 (Ser1943)是干性和LR的治疗靶点,并预测HCC患者的不良预后和LR。
研究小结
03
总之,本研究阐明了MYH9和p-MYH9 (Ser1943)/USP22/HIF-1α轴在肝癌中促进肿瘤干性和LR的机制。靶向p-MYH9 (Ser1943)和USP22, CX-4945和S02分别可以消除hif -1α诱导的LR,为HCC和LR患者提供了潜在的有效治疗选择。(转化医学网360zhyx.com)
【参考资料】
https://www.nature.com/articles/s41392-024-01963-5#Sec10
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发