抑制胶质瘤体内进展!中山大学张弩教授团队:发现肿瘤免疫治疗新靶点
| 导读 | 免疫抑制性肿瘤微环境(tumor microenvironment, TME)是胶质母细胞瘤(glioblastoma, GBM)的一个突出特征,胶质母细胞瘤是最致命的原发性脑肿瘤,对目前的免疫疗法耐药。GBM-TME的发病机制有待进一步研究。 |
10月30日,中山大学张弩教授研究团队在期刊《Cell Reports Medicine》上发表了研究论文,题为“Lnc-H19-derived protein shapes the immunosuppressive microenvironment of glioblastoma”,本研究中,研究人员发现长链非编码RNA (LncRNA) H19编码一种称为H19-IRP的免疫相关蛋白。H19- irp从H19 RNA中分离出来,通过与CCL2和Galectin-9启动子结合并激活其转录,从而促进GBM免疫抑制,进而招募髓源性抑制细胞(MDSCs)和肿瘤相关巨噬细胞(TAMs),导致T细胞耗竭和免疫抑制性GBM- TME。H19-IRP在临床GBM样本中过表达,作为主要组织相容性复合体I类(MHC-I)呈递的肿瘤相关抗原(TAA)发挥作用。靶向H19-IRP的环状RNA疫苗(circH19-vac)可触发针对GBM的强效细胞毒性T细胞应答,并抑制GBM生长。本研究结果强调了H19-IRP通过招募MDSCs和TAMs来产生免疫抑制性GBM-TME的功能,支持了以H19-IRP为靶点的肿瘤疫苗用于GBM治疗的想法。

https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00553-6
背景信息
01
胶质母细胞瘤(GBM)是成人最常见和最致命的脑肿瘤。由于治疗方案有限,患者结局较坏,中位生存期不足2年。尽管目前可用的免疫疗法已被证明可使各种类型的癌症患者获益,包括结直肠癌、黑色素瘤、非小细胞肺癌和肾细胞癌,但在GBM的免疫疗法临床试验中尚未证明满意的疗效和结局。
GBM对目前的免疫治疗方法显示出显著的耐药性。免疫检查点阻断(ICB)疗法是目前主流的免疫疗法,旨在增强T细胞的抗肿瘤能力。然而,GBM中密集的免疫抑制细胞,加上稀疏的T细胞浸润,严重限制了ICB的治疗效力。此外,免疫逃逸是包括GBM在内的恶性肿瘤的一个标志。GBM可通过DNA甲基化等表观遗传修饰增强肿瘤微环境(tumor microenvironment, TME)免疫抑制,促进免疫逃逸。免疫治疗失败的原因是GBM-TME具有高度的免疫敌意。免疫抑制性GBM-TME的机制是多方面的;影响因素包括肿瘤细胞的突变负荷低、免疫抑制性髓系细胞的高浸润、效应T细胞的缺乏和有效抗原的缺乏。GBM免疫治疗最关键的挑战是如何克服高度免疫抑制的TME。
TME中的多种细胞群与免疫抑制的调节和促进脑癌进展有关。例如,研究表明,在GBM中,骨髓来源的巨噬细胞倾向于表现出免疫抑制表型,从而促进肿瘤进展。GBM的单细胞RNA测序(scRNA-seq)图谱也显示肿瘤的进展与免疫抑制细胞(如TAMs和MDSCs)的浸润相一致。具有免疫抑制作用的TME也会影响疗效。TME中缺乏细胞毒性T细胞、记忆性T细胞、TH1细胞和其他淋巴细胞浸润,往往导致免疫治疗效果不佳。基于上述发现,近年来的研究尝试将“冷” TME转变为“热” TME作为治疗策略。然而,这些策略仍处于临床前阶段,临床获益不确定。因此,迫切需要寻找更有效的靶点来改善或逆转免疫抑制性GBM-TME。
H19-IRP是一种TAA,具有作为疫苗靶点的潜在价值
02
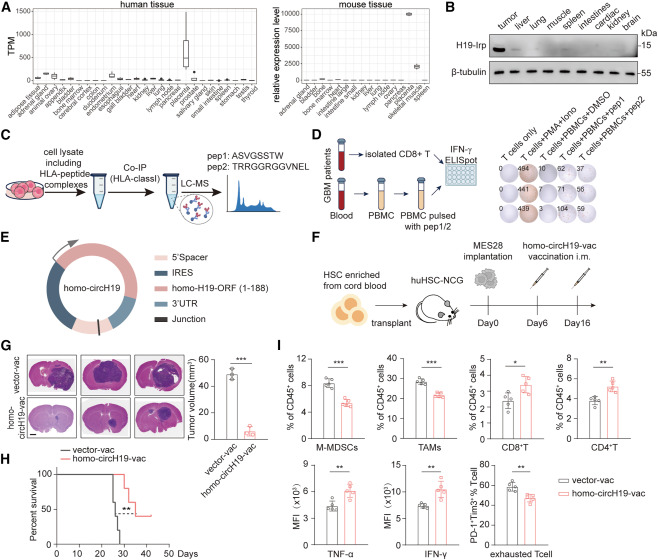
H19-IRP在肿瘤细胞中的高度特异性表达,提示H19-IRP可作为肿瘤疫苗的靶点。接下来,研究人员探讨了H19-IRP作为疫苗靶点的可行性。研究人员在GEO数据集中研究了人类和小鼠H19的表达,发现H19仅在人类和小鼠胎盘中高表达,而在其他器官中相对低水平表达,这表明H19在一般人群的体细胞中呈低水平表达。对GBM肿瘤组织和正常组织的免疫印迹也一致表明,H19-Irp在肿瘤组织中特别高表达,而不是其他健康器官组织。研究人员接下来研究了H19-IRP是否可以通过主要组织相容性复合体I类(MHC-I)呈现。研究人员在MES28中进行了人类白细胞抗原(HLA)-I免疫沉淀,然后进行了MS。将质谱结果与H19-IRP序列进行匹配后,研究人员鉴定出了两个来源于H19-IRP的HLA - I结合肽。研究人员接下来研究了H19 - IRP来源的肽是否可以有效地激活CD8+T细胞。H19 - IRP来源的多肽与PBMCs共培养后,外周血T细胞释放大量的IFN-γ。综上所述,这些结果表明H19-IRP在肿瘤中特异性表达,并表现出相当的抗原免疫原性,提示其可能是一个有希望的肿瘤疫苗的靶点。
H19-IRP是一种肿瘤相关抗原,具有作为疫苗靶点的潜在价值
为了制备靶向H19-IRP的环状RNA疫苗,研究人员将H19-ORF线性合成circH19,并将circH19包被脂质纳米颗粒(LNPs),制备环状RNA疫苗(circH19-vac)。荧光素酶活性和H19-Irp水平发生显著变化,表明circH19在体外成功表达。接下来,研究人员通过肌肉注射给小鼠circH19-vac。与空载体组相比,circH19-vac组小鼠表现出更强的发光活性。这些数据表明,circH19-vac在体外和体内都能高效表达H19-IRP抗原。
研究人员将免疫小鼠脾细胞与转染circH19的骨髓来源树突状细胞(BMDCs)共培养24 h,采用IFN-γ酶联免疫斑点法(ELISpot)检测CD8+T细胞的活化情况。circH19疫苗接种小鼠的脾T细胞在体外被转染circH19的BMDCs攻击后释放大量的IFN-γ。为了进一步评估circH19-vac的治疗潜力,研究人员通过疫苗接种策略免疫了携带GL261原位肿瘤的C57BL/6小鼠。CircH19-vac显著降低肿瘤体积,延长生存期。研究人员发现circH19-vac组小鼠的TME发生重塑,M-MDSCs和TAMs减少,CD8+和CD4+T细胞增多,T细胞杀伤能力增强,耗竭程度降低。
为探索靶向人H19-IRP的疫苗的临床应用潜力,研究人员进一步设计了靶向人H19-IRP的疫苗。为了保护这些免疫原性序列并避免潜在的促肿瘤作用,研究人员选择H19-IRP的1 ~ 188个氨基酸序列构建了人circH19 (homo-circH19),并在其表面涂以LNPs制备了环状RNA疫苗(homo-circH19-vac)。为了评估homo-circH19-vac的治疗效果,研究人员通过疫苗策略免疫了带有MES28原位肿瘤的人源化小鼠模型huHSC-NCG小鼠。与circH19-vac观察到的效果一致,homo-circH19-vac显著缩小了肿瘤体积,延长了小鼠生存期。此外,研究人员观察到homo-circH19-vac组的TME发生重塑,M-MDSCs和TAMs减少,CD8+T细胞和CD4+T细胞增加,T细胞毒性增强,T细胞耗竭水平降低。这些数据表明,利用LncRNA衍生的抗原肽的肿瘤疫苗可能是一种有效的肿瘤免疫治疗策略。
结论
03
综上所述,研究人员鉴定了一个之前未检测到的蛋白,H19-IRP,它在形成GBM的免疫抑制性TME中起着重要的作用。环状RNA疫苗circH19-vac的制备及其在临床前模型中的疗效强调了本研究的治疗价值。因此,H19-IRP是增强GBM免疫治疗疗效的一个安全且有前景的免疫治疗靶点。(转化医学网360zhyx.com)
【参考资料】
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00553-6
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发