新式“水凝胶系统”!天津医科大学合作发文:有前途的癌症治疗新策略
| 导读 | 程序性死亡配体1(PD-L1)是一种关键的免疫检查点蛋白,有助于肿瘤逃避免疫系统。虽然基于抗体的PD-1/PD-L1抑制剂显示出了希望,但其局限性促使人们开发其他治疗策略。 |
11月12日,天津医科大学与南开大学研究人员合作共同在期刊《Advanced Science》上发表了题为“Intrinsic PD-L1 Degradation Induced by a Novel Self-Assembling Hexapeptide for Enhanced Cancer Immunotherapy”的研究论文,本研究中,研究人员通过开发一种由六肽组成的化合物KFM(精氨酸-苯丙氨酸-甲硫氨酸-苯丙氨酸-甲硫氨酸-精氨酸),解决了这些挑战。KFM既可以直接下调PD-L1,又能自组装成一种对ROS(活性氧)敏感的超分子水凝胶。这种双重功能使Gel KFM能够作为一种局部药物递送系统和PD-L1抑制剂发挥作用。研究人员将抗癌药物米托蒽醌(MTX)和二甲双胍(MET)装载到水凝胶中,进一步通过将化疗与PD-L1下调相结合来增强治疗效果。体外和体内研究表明,在肿瘤周围注射后,肿瘤生长受到显著抑制,CD8+ T细胞浸润增加,肿瘤内PD-L1表达减少。从机制上讲,KFM通过依赖泛素途径促进PD-L1降解。这种“无载体”的递送系统将超分子水凝胶在癌症治疗中的作用从被动载体扩展到了主动免疫治疗剂,为癌症治疗提供了一种有前途的新策略。

https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202410145
研究背景
01
PD-L1是一种关键的免疫检查点蛋白,被认为是癌细胞免疫侵袭的主要机制。肿瘤细胞与T细胞之间的PD-1/PD-L1相互作用抑制了细胞毒性T细胞的活性,使癌细胞能够逃避免疫监视。免疫疗法,特别是基于抗体的PD-1/PD-L1抑制剂,如帕博利珠单抗和纳武利尤单抗,在临床上已显示出持续的抗肿瘤效果和延长患者生存期。然而,靶向PD-1/PD-L1的治疗性阻断抗体面临着包括免疫相关不良事件、潜在的抗原反应、高昂的经济成本和由于大分子尺寸和稳定性而导致的有限肿瘤组织渗透性等挑战。这些问题需要探索非抗体PD-L1治疗药物和创新的递送系统,以提高临床益处并减轻经济负担。
下调PD-L1的表达,而不是仅仅阻止其与PD-1的相互作用,可能是实现持久抗肿瘤免疫反应的有希望的策略。通过减少肿瘤细胞中的PD-L1积累,这些药物可以增强肿瘤浸润T细胞的活性,并可能增强长期抗肿瘤免疫力。目前有多种小分子转录/表观遗传调节剂正在进行早期临床试验,以调控PD-L1。肽是氨基酸通过肽键连接形成的一类混合型治疗剂,具有合成简单、生物相容性和显著的多功能性等优点。尽管理论上具有优势,但目前仅报道了少量靶向/结合PD-L1的肽类,尚未发现有效的PD-L1下调肽类。
凝胶KFM诱导PD-L1下调的机制研究
02
为了阐明研究人员设计的肽水凝胶抑制PD-L1的作用机制,研究人员对用Gel KFM处理的4T1肿瘤组织进行了基于质谱的蛋白质组分析。研究人员对量化的蛋白质进行层次聚类分析揭示了每个处理组(PBS、Gel KFM和Gel@MTX/MET)独特的蛋白质组谱。基因集变异分析(GSVA)进一步证实了这种强有力的聚类,并确定了细胞组分、生物过程、分子功能和途径之间的显著组间差异。值得注意的是,分析突出了泛素依赖的蛋白质降解过程作为肽水凝胶介导的PD-L1下调的关键通路。该通路的特点是参与泛素化过程的基因上调,包括与蛋白质泛素化正调控相关的基因、泛素结合酶活性相关的基因、泛素蛋白酶结合相关的基因和泛素结合相关的基因。
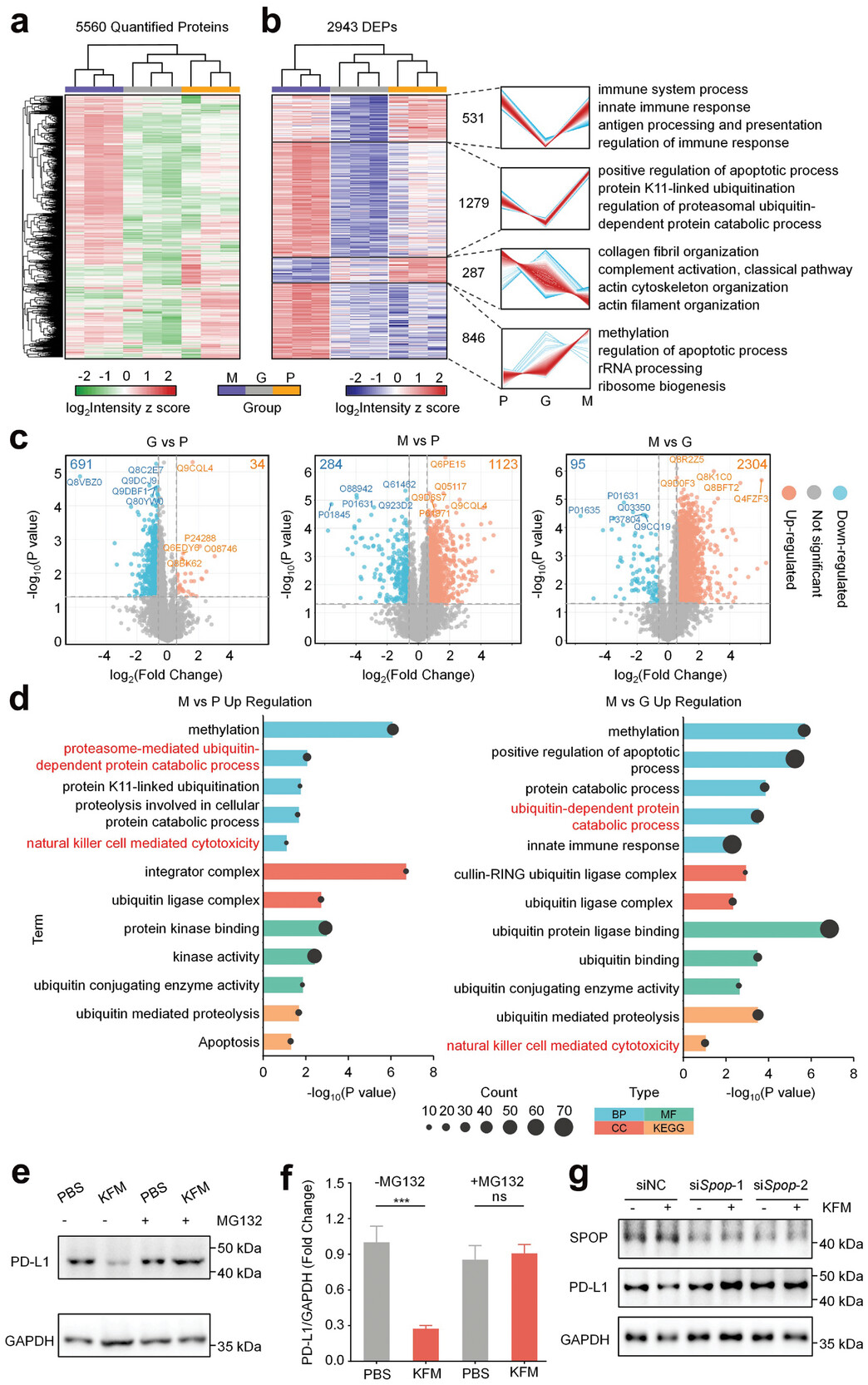
图1:治疗组间肿瘤组织的蛋白质组学分析
为了验证泛素-蛋白酶体通路在Gel KFM介导的PD-L1下调中的作用,研究人员研究了蛋白酶体抑制剂MG132对Gel KFM处理细胞的影响。如图1e、f所示,MG132治疗有效地抑制了Gel KFM诱导的PD-L1蛋白水平的降低,证实了这种下调发生在蛋白质水平上,并依赖于蛋白酶体。尤其是,尽管Gel KFM治疗降低了PD-L1蛋白水平,但研究人员观察到PD-L1 mRNA表达增加,这表明PD-L1蛋白减少可能触发了一种潜在的补偿性反馈机制。此外,研究人员研究了泛素-蛋白酶体通路的作用,特别是SPOP。SPOP在蛋白质泛素化和随后的降解中发挥重要作用。研究人员进行了靶向SPOP的siRNA敲低研究,以评估其在PD-L1调节途径中的作用。如图1f所示,siRNA介导的SPOP敲低(siSpop)有效地降低了SPOP在KFM处理和未处理细胞中的表达水平。值得注意的是,单独使用KFM治疗可显著下调PD-L1表达,但在SPOP敲除细胞中,这种效应明显减弱。对这些结果进行定量分析进一步证实了这一观察结果。这些发现提供了令人信服的证据,表明KFM诱导的PD-L1下调很可能是通过增强泛素化,导致PD-L1的加速蛋白酶体降解实现的。SPOP敲除细胞中KFM对PD-L1水平的影响被逆转,强烈表明SPOP作为CRL3 E3连接酶复合物的一部分,在该过程中发挥着关键作用。
此外,进一步证实了泛素-蛋白酶体通路的参与,Gel@MTX/MET组中出现了UBE2D3、KLHL22、UBE4B和PSMF1等蛋白质的表达增加,这些蛋白质参与了泛素化、PD-1稳态和蛋白酶体调节。此外,研究人员观察到Gel@MTX/MET组中自然杀伤(NK)细胞介导的细胞毒性通路的上调。这一发现与先前的研究相符,该研究表明MET能够激活NK细胞。
综上所述,本研究结果表明,观察到的Gel@MTX/MET增强的抗肿瘤免疫作用涉及多个方面,包括通过泛素-蛋白酶体途径下调PD-L1和增强NK细胞活性。这些结果凸显了这种基于肽的水凝胶系统的潜力,作为一种新型的癌症治疗方法。(转化医学网360zhyx.com)
【参考资料】
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202410145
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发