Nature子刊:开发靶向FZD/SMO抗癌药物新思路!
| 导读 | G蛋白偶联受体(GPCRs)是人体内最大的膜受体蛋白家族,其介导的信号通路已经被证明是原癌基因信号的关键调控者,而GPCRs则是很好的药物靶点。但有研究证实F类GPCRs(FZD/SMO)具有结构保守性,其在受体激活后的结构变化始终难以盖棺定论,导致靶向FZD/SMO的抗癌药物研究停滞不前。 |

G蛋白偶联受体(GPCRs)是人体内最大的膜受体蛋白家族,其介导的信号通路已经被证明是原癌基因信号的关键调控者,而GPCRs则是很好的药物靶点。但有研究证实F类GPCRs(FZD/ SMO)具有结构保守性,其在受体激活后的结构变化始终难以盖棺定论,导致靶向FZD/ SMO的抗癌药物研究停滞不前。近日,卡罗林斯卡研究所的研究人员发现一种特殊的氨基酸——受体跨膜区TM6/7间的接触网可作为介导FZD/ SMO激活的开关,同时确认了其癌症驱动机制,为将来开发靶向FZD/ SMO的抗癌药提供了新方向。

FZD/ SMO——突变热点,研究冰点
FZD/ SMO是一类高度保守的信号分子,作为Wnt信号通路的受体,通过与Wnt配体结合来激活下游的信号传导通路。激活后可引起基质中信号通路下游散乱蛋白的激活,在调节胚胎发育,细胞极性,神经突触的形成,细胞增殖等多个过程中扮演重要角色。
这些调控涉及经典Wnt/β-catenin通路、Wnt/calcium通路和平面细胞极性(PCP)通路,有研究指出,FZD/ SMO在肿瘤细胞系和组织中频繁上调,可异常激活相关信号通路,与多种癌症的发生发展密切相关。但作为肿瘤中突变热FZD/ SMO并未带来相应靶向药的开发热潮,反而因为其激活机制始终未明而导致相关研究降至冰点。想要破冰,首要任务就是明了高度保守的FZD/ SMO偏偏在肿瘤中异常激活的机制。
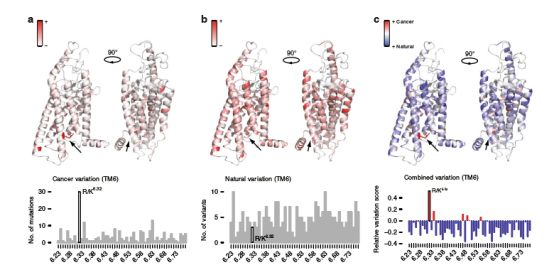
TM6在多种癌症中都存在突变
TM6/7接触网——激活FZD/ SMO的“开关”
研究人员对66,402个癌症基因组进行FZD/ SMO突变投影时,发现TM6下部(R/K6.32)的突变在癌症中普遍存在。对R/K6.32突变位置进行归一化处理后,他们对超过12万人的基因进行分析,发现R/K6.32在人群中具有可检测的突变性,但在健康人体内的突变率极小,也就是说,R/K6.32突变多发生在肿瘤人群中。这就证实了该氨基酸正是异常激活FZD/ SMO,引起肿瘤发生发展的“开关”。
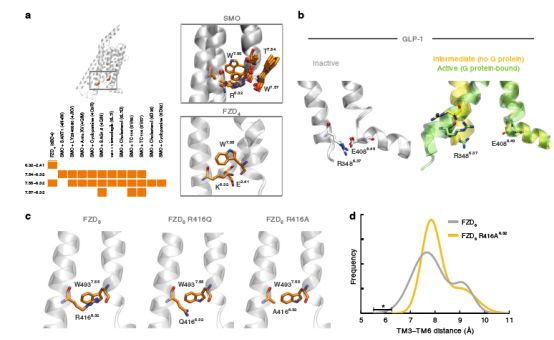
R/K6.32的开关机制
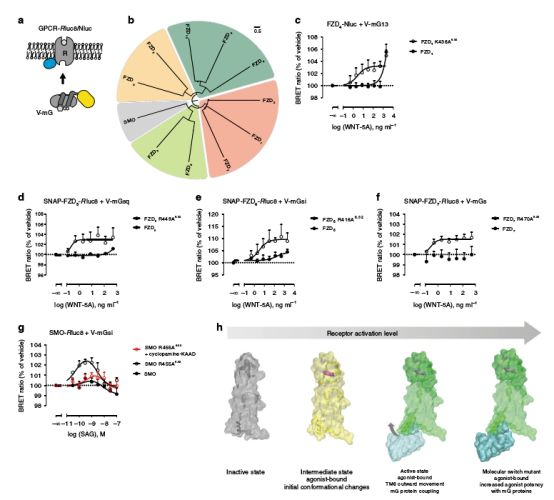
R/K6.32的激活作用
在所有测试的FZD/ SMO(FZD4,5,6,7,SMO)中,R/K6.32突变可稳定FZD/ SMO激动剂的活性构象,使激动剂效力增加。只要破坏R/K6.32突变,就可消除FZD/ SMO与磷蛋白间的功能性相互作用。
研究人员对已公布的几项SMO晶体进行分析,发现R/K6.32正是TM6与TM7之间存在着π-阳离子和氢键特殊相互作用的氨基酸,其充当了FZD/ SMO “活化剂”,使得原本不应该活跃的癌症突变体变得“活泼”,导致FZD/ SMO异常活化上调,随后,FZD/ SMO的促癌“开关”——R416Q6.32与W493L7.55开启,其天然癌症突变体使得磷蛋白DVL高度富集与磷酸化,引发相应信号通路过度活跃,导致癌症的发生。
研究FZD/ SMO的激活机制对肿瘤的治疗具有重要意义。这项发现无疑为未来开发高通量兼容的筛选试验提供了新型方案,同时也为部分癌症的治疗药物提供了新的研究方向。未来,我们有望根据该机制操纵相应信号通路,特色定制个性化抗癌药,为癌症的精准医疗提供更多助益。
参考文献:
1.Gunnar Schulte,et al. A conserved molecular switch in Class F receptors regulates receptor activation and pathway selection. Nature Communicationsvolume 10, Article number: 667 (2019) .
2. Tailored Cancer Drugs from New Cell Receptor Insights
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发