【中泰证券深度报告】“基因剪刀”开启“造物主之梦”平民化新时代
| 导读 | 12月18日晚,美国《科学》杂志公布了其评选的2015年十大科学突破,被业内誉为“基因剪刀”的CRISPR基因组编辑技术当选今年头号突破,《科学》杂志执行新闻编辑约翰•特拉维斯说,这是一个“前所未有的选择”,因为这项技术过去两次入选《科学》年度十大突破,今年“晋升”到头号突破。 |

卷首语
1)12月18日晚,美国《科学》杂志公布了其评选的2015年十大科学突破,被业内誉为“基因剪刀”的CRISPR基因组编辑技术当选今年头号突破,《科学》杂志执行新闻编辑约翰•特拉维斯说,这是一个“前所未有的选择”,因为这项技术过去两次入选《科学》年度十大突破,今年“晋升”到头号突破;2)目前第三代基因编辑技术CRISPR-Cas9正在基因工程领域引起一场革命性的巨变,并因此席卷全球的顶尖大学、研究院以及医疗生物企业实验室。其相对前两代技术廉价、迅速、简单的压倒性优势,将会彻底颠覆传统的人类遗传性疾病和肿瘤的治疗方法;3)中国对于基因编辑技术的研究与应用处于国际最前沿的领军低位:今年4月,中山大学生物学家黄军就发表了全球第一篇有关“基因剪刀”技术修改人类胚胎的研究报告,并于12月18日入选Nature 2015年十大人物;4)与此同时,近期,国内精准医疗旗舰——华大基因招股说明书预披露及首个精准医疗指数基金——汇添富中证精准医疗主题指数型基金发布招募说明书,都将为整个精准医疗主题带来短期强风口;5)自我们中泰策略团队12月16日独家发布精准医疗主题系列报告第一篇《干细胞治疗专题深度报告:全球“多重奏”接踵而至,“精准+肿瘤”助力新腾飞》深度报告,精准自底部持续推荐“精准医疗-干细胞治疗”主题以来,我们重点推荐的四只股票:中源协和、新开源等一周以来涨幅均超过30%;5)本篇报告,我们将深度研究被称为“基因剪刀”的CRISPR基因组编辑技术这一2015年最重要科学突破的原理、优势、应用领域、海外公司产业化案例、未来催化及投资建议等。
核心观点
1. 基因编辑作为自由改写“DNA生命之书”的“剪刀”,在改写人类基因治疗肿瘤艾滋病等世界难题、重塑动植物性状方面具备“颠覆性变革”,是精准医疗工程的核心技术,但成本过高及脱靶率高是制约早期基因编辑技术发展的瓶颈;2. 第三代基因编辑技术CRISPR因其低脱靶率、简单廉价、多点操作等革命性特征,可以快速普及至中小实验室,开启了基因工程“平民化时代”,2012年发现至今,已有遏制疟疾、艾滋病等成功临床应用。同时,我国在该领域居国际领先地位,中山大学黄军就获2015年Nature 十大人物;3. 通过对海外最先进基因编辑公司的梳理,我们可以发现,肿瘤、艾滋病是其主要应用方向,深度产业化是其根本特征,最先进产业资本持续运作+2016-2017关键药物试验集中出现是其持续性催化;4. 站在资本市场角度:短期看,Science+Nature年度头号突破+华大上市+精准医疗基金发行,基因编辑主题短期迎来多重重磅催化;中长期看,基因工程大规模商用化“拐点”+国际资本持续运作+明后年药物试验集中上市+伦理规制确定都将带来基因编辑主题持续性催化。同时,其也将随整个精准医疗主题一起共享2016年全球“多重奏”;5.在精准医疗大主题中,基因-细胞免疫治疗子方向将直接受益第三代基因编辑CRISPR的重大突破,是短期最具爆发潜力的子方向,我们强烈推荐关注该方向下的“五虎上将”:安科生物、中源协和、达安基因、新开源、香雪制药。
摘要
基因编辑技术:自由改写“DNA生命之书”的“墨笔”,在改写人类基因、重塑动物、工程植物三大方面颠覆“想象”。
1)原理:所谓基因编辑技术,是指对DNA核苷酸序列进行删除和插入等操作,换句话说,基因编辑技术使得人们可以依靠自己的意愿改写DNA这本由脱氧核苷酸写而成的生命之书,换言之,基因编辑技术让人类第一次有机会实现“造物主”之梦;
2)应用空间:第一,改写人类基因:体细胞基因编辑技术通过改造人类体细胞的缺陷基因实现对遗传性疾病的治疗,同时又不影响对患者后代的基因遗传,这是其他所有的基因工程技术所不能做到的。今年10月份,科学家使用基因编辑技术成功实现了世界首例婴儿白血病治疗;第二,重塑动物和植物:其可以为动植物塑造出任何人类想要的性状,能够彻底颠覆动物育种界已有认知,而且成功率可以达到30%以上,比其他的基因改造技术高出好几个数量级基因编辑技术。目前已有乳牛、马铃薯等动植物成功接受商业化的基因改良,杜邦公司认为首批基因编辑食物将会在五年内被端上餐桌;
3)技术发展路径及壁垒:1.早期基因编辑技术的临床应用:锌指核酸酶(ZFN)与转录激活因子效应物核酸酶(TALEN)分别是第一、二代基因编辑技术,由于发明的时间较早,它们在临床治疗方面已经有了成功的应用,例如,基于ZFN技术的艾滋病治疗药物已进入三期临床试验阶段,而基于TALEN技术已可被用于治愈英国儿童白血病;2.脱靶率高且价格昂贵是制约早期基因编辑技术瓶颈:然而,由于前两代技术DNA序列识别特异性低易造成脱靶,从而引发严重的安全问题,降低脱靶率是基因编辑技术推广需要解决的最关键的技术难题。同时,每次高达5000美元以上的采购费用也是制约其向普通实验室推广的关键。
4)我们认为,这些早期的基因编辑技术的成功运用一方面,打通了基因编辑临床化的道路,后续更成熟技术的普及速度将大大加快;另一方面,在技术尚不完全成熟,同时,成本较高的情况下,基因编辑临床化的逐步展开,也反映了市场和医学对于基因编辑的迫切需求,当第三代基因编辑技术CRISPR/Cas9突破关键瓶颈后,基因编辑市场有望迎来爆发。
第三代基因编辑技术CRISPR/Cas9:生物医学史上第一种可高效、精确、程序化且简单廉价地修改人类基因组的工具,开启基因工程“平民化”新时代。
1)原理:与前两代基因编辑原理完全不同,CRISPR全名为“成簇的、规律间隔的短回文重复序列”,是细菌防御病毒入侵的一种机制,广泛存在于大多数细菌之中,其机制在于通过RNA以碱基的互补配对的方式对外源DNA进行识别。2012年才被科学家发现并加以利用,成为生物医学史上第一种可高效、精确、程序化地修改细胞基因组包括人类基因组的工具。
2)低脱靶率、简单廉价、多点操作是其革命性特征。首先,相比起前两代使用蛋白质识别的方法,基于RNA的CRISPR对DNA序列的识别要精确更多,这解决了基因编辑最重要的瓶颈——降低了脱靶切割的几率,减低了细胞毒性;其次,CRISPR的构建仅需采购少量RNA且过程极为简便,全部花费由5000美元降为30美元,普通实验室也可自行构建,开启了基因工程大规模应用“平民化”的新时代;再次,CRISPR可用位置更多且可一次多点操作。配对碱基对找到的概率从上千个降为每8个碱基对就可找到一个位点,这使得其理论上能对任一基因进行操作。
3)目前已有的成功商业化临床应用:自去年麻省理工首次成功利用CRISPR修正了代谢性疾病相关的突变tyrosinaemia以来,CRISPR技术临床应用突飞猛进,已有的重大突破包括:遏制疟疾传播、清除艾滋病病毒等。展望未来,所有上文中提及的基因编辑应用领域,CRISPR均可以更加高效、廉价的方式快速普及,同时其也可以与干细胞治疗、细胞免疫等其他精准技术深度结合,是精准医疗方案不可或缺的组成部分,有望颠覆现有遗传病、癌症、艾滋病等重大疑难疾病的治疗方法。
4)我国在CRISPR临床应用的研究中处于国际领军地位:黄军就入选Nature 2015十大年度人物。我国在这一领域的临床应用的研究属于国际公认的领军地位,今年4月中山大学黄军就团队队利用CRISPR技术,试图修改人类胚胎中HBB基因以治疗地中海贫血症的文章发表于全球最权威科技期刊Nature,12月18日,黄军就本人入选Nature 2015十大年度人物。
他山之石:海外专注于基因编辑的生物科技公司的商业模式的启示。通过对四家海外目前较为成功的专注于基因编辑的生物科技公司——全球首家基因编辑技术公司Caribou Biosciences、CRISPR技术发明人团队Editas Medicine、专注CRISPR在细胞治疗和造血干细胞中应用的Intellia Therapeutics以及有望打开艾滋病治疗的“新天地”Sangamo的公司创始情况、融资方式、核心技术、应用领域、在研产品等方面的梳理,我们可以得出四点启示:第一,第三代基因编辑技术CRISPR自诞生之日起就深度与产业化、商业化相结合,主要技术发明人均是重要公司创始人,这意味着其后续大规模应用的速度将超出想象;第二,全球最先进的产业资本:谷歌、微软、扎克伯格均对于第三代基因编辑技术CRISPR/Cas9投入不计成本,这意味着其巨大的应用前景及市场空间已得到全球公认;第三,从几家公司技术路线看,艾滋病、癌症是应用的最重点领域,而CRISPR基因编辑与造血干细胞治疗、CAR-T肿瘤细胞治疗等深度结合,将是精准医疗真正大规模商业化的开端,也将是未来最有潜力的发展方向;第四,从各家公司在研产品看,2016-2017年有望药品集中上市、重大临床试验集中展开。
资本市场视角:短期多重催化,主题有望集中爆发,中长期:精准医疗“技术拐点”叠加全球“多重奏”
主题短期强催化:Science+Nature年度头号突破+华大上市+精准医疗基金 ,基因编辑主题短期迎来多重重磅催化。1)无论从顶尖荣誉的层次(Science 2015年全球“前所未有”头号突破);国内科研在该领域的地位(黄军就团队荣获Nature 2015年十大人物);政策的持续扶持力度(精准医疗不仅有望成为上升“十三五”重大科技专项,而且第一时间受到习总高度关注,且已明确投入600亿元)以及不易证伪性(CRISPR基因组编辑可以快速、廉价大规模推广,开启基因工程平民化新时代),精准医疗-基因编辑短期的弹性有望集中爆发;2)与此同时,12月17日-18日,国内精准医疗旗舰——华大基因招股说明书预披露及首个精准医疗指数基金——汇添富中证精准医疗主题指数型基金发布招募说明书,都将为整个精准医疗主题带来短期强风口。
主题内生技术催化:基因工程大规模商用化+国际资本持续运作+明后年药物试验集中上市+规制确定。1)从技术角度:我们认为与其他更靠近基础科学的科技前沿主题难以落地不同,本次备受瞩目的的第三代基因编辑技术CRISPR最大贡献在于通过其高安全性、高效、廉价、简易的特点,能够快速被普通企业与中小实验室采用,开启了基因工程“平民化”的新时代。我们认为,第三代基因编辑技术实际上标志着整个基因工程-精准医疗从概念期向大规模应用爆发的“技术拐点”的到来,这是我们坚定看好精准医疗-基因编辑的根本原因;2)从规制角度:12月初华盛顿首届基因编辑国际峰会“研究-伦理”共识已达成,后续各国持续加码将成大概率事件;3)从产业资本和在研药物角度:通过对海外基因编辑公司的梳理,国际最先进产业资本微软、谷歌、facebook持续投入和2016-2017年一批关键药物及临床试验有望集中展开也将为精准医疗-基因编辑主题带来持续性催化。
更大背景的思考:精准医疗在2016年将迎来中、美、欧“多重奏”。我们在《全球“多重奏”之下,“精准+肿瘤”助力干细胞腾飞!——干细胞治疗深度报告》中就已经明确指出,我们看好精准医疗在2016年爆发的主要逻辑,除了基本面上广阔的应用前景外,更重要的是其在2016年将面临全球及国内多重催化剂的持续“共振”:1)从美国看,“FDA III期+大选政治周期”将使得奥巴马政府进一步加码包括干细胞治疗、精准医疗在内的高端生物医药成为大概率事件;2)从欧洲看,首个干细胞药物大概率获批上市将带来示范效应,同时,参考工业4.0各国政策加码经验,欧洲版精准医疗方案也有望继中、美后推出;3)从国内政策看,精准医疗成为十三五重大科技专项,上升国家战略也将带来强催化。强烈建议投资者阅读我们的深度报告。
投资建议新思考:多重强催化之下,关注基因治疗子方向“五虎上将”。考虑到本周末一系列重磅催化:Science+Nature年度头号突破+华大上市+精准医疗基金,我们认为,在精准医疗大主题中,基因-细胞免疫治疗子方向将直接受益第三代基因编辑CRISPR的重大突破,是短期最具爆发潜力的子方向,我们强烈推荐关注该方向下的“五虎上将”:安科生物、中源协和、达安基因、新开源、香雪制药。


目录

基因编辑技术应用前景
基因编辑技术与应用:自由改写“DNA生命之书”的“墨笔”
基因编辑技术原理概述:DNA靶点序列精确切割,定点编辑。所谓基因编辑技术,是指对DNA核苷酸序列进行删除和插入等操作,换句话说,基因编辑技术使得人们可以依靠自己的意愿改写DNA这本由脱氧核苷酸写而成的生命之书。基因编辑技术的主要原理是通过精确识别靶细胞DNA片段中靶点的核苷酸序列,利用核酸内切酶蛋白对DNA靶点序列进行切割,从而完成对靶细胞DNA目的基因片段的精确编辑。
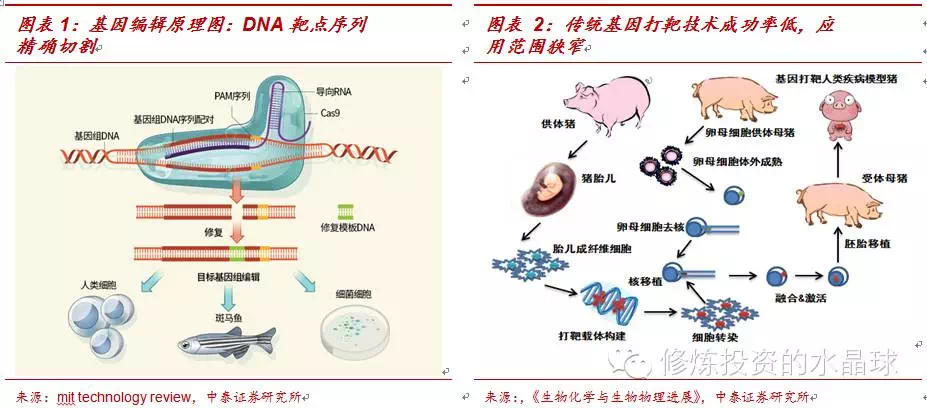
基因编辑技术的突破为“伦理天花板”下遗传性疾病治疗提供了一条全新的道路。基因编辑技术与其他基因工程技术相比有革命性突破,而且有巨大的临床医学应用价值:1)与传统杂交育种技术和转基因技术相比,杂交育种和转基因不能实现对基因片段的精确改造,因为他们主要依靠自然的同源重组方式完成,对改造的基因的位置不可控,因而成功率很低,通常小于10-3,要筛选出符合要求的基因性状需要好几代的杂交,时间往往长达1年左右;2)与基因打靶技术相比,后来的基因打靶技术虽然可以实现基因的敲除和替换,但是它技术难度很大,应用范围很窄,通常只在植物和小老鼠的胚胎细胞上有较大成功概率,而在大型哺乳动物,例如牛和羊身上则成功率很低,因此极大地限制了它的商业和临床应用。
基因编辑技术是一个革命性的技术:一方面,它可以应用在植物、小动物、大型哺乳动物上,而且成功率可以达到30%以上,比其他的基因改造技术高出好几个数量级;更重要的是,基因编辑技术的应用范围不仅仅在具有遗传效应的生殖细胞或胚胎细胞中,它可以应用在人类的体细胞上,通过改造人类体细胞的缺陷基因实现对遗传性疾病的治疗,同时又不影响对患者后代的基因遗传,这是其他所有的基因工程技术所不能做到的。
基因治疗的方法主要分为对体细胞的基因治疗和对生殖/胚胎细胞的基因治疗,在目前后者技术非常不成熟,对人的生殖/胚胎细胞进行基因改造有重大的伦理道德争议,以及全世界大多数国家法律禁止对人的生殖/胚胎细胞进行基因改造的背景下,基因编辑技术无疑为遗传性疾病治疗提供了一条全新的道路。可以预期,在未来,随着基因编辑技术的不断成熟,科研人员将会研发出越来越多的针对治疗遗传性疾病的基因治疗方法,这将会彻底颠覆传统的人类遗传性疾病治疗方法,并且为基因编辑治疗方法打开一个巨大的市场。届时,那些在基因编辑技术领域投入最早、而且首先抢下基因编辑技术的知识产权的公司,将会享受巨额回报。
今年10月份,科学家使用基因编辑技术成功实现了世界首例婴儿白血病治疗。英国一名1岁大女婴患上了急性淋巴细胞白血病,化疗及骨髓移植均不奏效。于是医生采用德国生物技术公司Cellectis开创的采用第二代基因编辑技术---TALENS为她进行治疗。首先医生在捐赠的血液细胞中添加抗白血病基因,这些基因可编码并产生杀死癌细胞的蛋白质,其次他们使用TALENs技术关闭两个基因,如今检测结果发现该患者身上的癌细胞已完全消除。由此可见,利用基因编辑技术矫正疾病突变,治疗人类疾病有着广阔的前景。
早期的基因编辑技术已经成功应用于临床,但降低脱靶率是关键技术难题
早期的基因编辑技术:锌指核酸酶(ZFN)与转录激活因子效应物核酸酶(TALEN)分别是第一、二代基因编辑技术。锌指核酸酶(ZFN)由锌指蛋白(ZF)和核酸内切酶组成,其中锌指蛋白构成DNA的识别域,它能识别DNA序列上的特异点位并与之结合,接着由核酸内切酶蛋白构成的切割域能特异性地在基因组特定位点切断DNA形成“双链断裂缺口”,双链断裂将会启动细胞内的DNA损伤修复机制,细胞可以通过同源重组修复机制修复DNA。相比起锌指核酸酶(ZFN)技术,转录激活因子效应物核酸酶(TALEN)主要是使用类转录激活子效应物TALE代替了锌指蛋白ZF作为DNA识别域---通过TALE 识别特异的DNA序列,然后令核酸内切酶在特定点将DNA序列精确切开。
由于TALEN使用了TALE分子代替ZF作为识别结构域,它能更好地解决ZFN对于DNA序列识别特异性低的问题,因此TALEN的脱靶切割几率比ZFN要低得很多。脱靶会导致细胞产生毒性,从而引发严重的安全问题,降低脱靶率是基因编辑技术推广需要解决的最关键的技术难题之一。TALEN的发明使基因组编辑的效率和可操作性得到了提高,对于目的片段的切割效率达到了近40%,是ZFN技术的两倍。但是构建TALE分子的过程比较复杂, 而且成本很高,通常要花费上千美元,这使得它在普通实验室的推广率很低。

锌指核酸酶(ZFN)与转录激活因子效应物核酸酶(TALEN)技术发明的时间较早,它们在临床治疗方面已经有了成功的应用。例如,在艾滋病治疗方面,Sangamo公司尝试用ZFN技术破坏CD4 T细胞内的内源基因CCRT,可以使HIV病毒失去重要的受体位点之一,从而抑制病毒的繁殖与传播。目前,该药物已进入三期临床试验阶段。而对于TALEN技术的临床应用,除了上面讲到的利用TALEN技术治疗英国儿童的白血病的例子以外,科学家成功利用TALEN对人胚肺293细胞的DNA的某些位点进行了定点敲除,还有一些科学家利用TALEN成功地对缺陷型BETA株蛋白基因进行了更改,使其恢复到正确序列。
我们认为,这些早期的基因编辑技术的成功运用一方面,打通了基因编辑临床化的道路,后续更成熟技术的普及速度将大大加快;另一方面,在技术尚不完全成熟,同时,成本较高的情况下,基因编辑临床化的逐步展开,也反映了市场和医学对于基因编辑的迫切需求,当第三代基因编辑技术CRISPR/Cas9突破关键瓶颈后,基因编辑市场有望迎来爆发。
第三代基因编辑技术CRISPR:生物医学史上第一种可高效、精确、程序化地修改人类基因组的工具
CRISPR/Cas9的原理简介:CRISPR全名为“成簇的、规律间隔的短回文重复序列”,是细菌防御病毒入侵的一种机制,2012年才被科学家发现并加以利用,成为生物医学史上第一种可高效、精确、程序化地修改细胞基因组包括人类基因组的工具。
与前两代基因编辑技术原理完全不同,CRISPR是细菌和古细菌在长期演化的过程中形成的一种适应性免疫防御,可以用来对抗入侵的病毒和外源DNA,其广泛存在于大多数的细菌和几乎所有的古细菌中。
CRISPR机制通过RNA以碱基的互补配对的方式对外源DNA进行识别,然后在相关Cas蛋白的帮助下,对病毒或噬菌体的DNA双链进行精确地切割,使其DNA双链断裂,从而杀死病毒或噬菌体细胞,保护细菌自身的生存。后来发现它广泛存在于原核生物基因(大多数的细菌和几乎所有的古细菌)中。
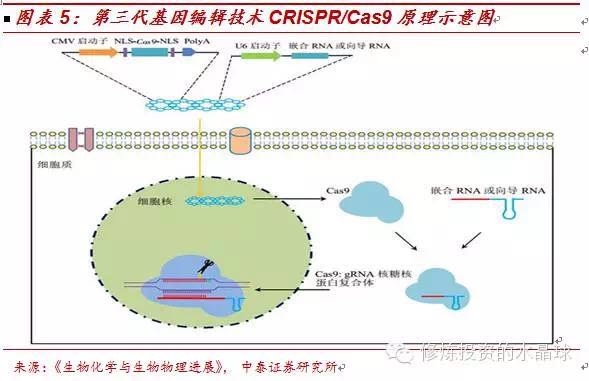
CRISPR/Cas9的革命性特征:低脱靶率、简单廉价、多点操作。CRISPR/Cas9与前两代基因编辑技术相比有压倒性优势,对基因工程领域的发展是革命性的:首先,相比起前两代基因编辑技术,第三代CRISPR/Cas9系统是一个天然存在的原核生物RNA干扰系统,其介导的基因组编辑是由RNA指导的,由于对靶序列的识别是RNA与DNA的碱基配对过程,相比起前两代使用蛋白质识别的方法,后者对DNA序列的识别要精确更多,这解决了基因编辑最重要的瓶颈——降低了脱靶切割的几率,减低了细胞毒性。
其次,CRISPR/Cas9的构建仅仅需要设计与靶序列互补的RNA即可,过程相对于TALEN更为简单和廉价,普通的实验室也可以自行完成构建,这大大提高了基因操作的效率及简便性。通常订购锌指核酸酶(ZFN)需要5000多美金,价格昂贵而且难以操作,因此锌指核酸酶(ZFN)并没有得到广泛应用。CRISPR却大不相同通常,研究人员需要订购的只是RNA片段,其他成分都是现成的,全部花费只有30美元,这一点极大地促进了这项技术的广泛应用,因此它被全世界大大小小的实验室、研究所争相使用。
再次,CRISPR-Cas9系统的可用位置更多。理论上基因组中每8个碱基就能找到一个可以用CRISPR-Cas9进行编辑的位置,可以说这一技术能对任一基因进行操作,而TALEN和ZFN系统则在数百甚至上千个碱基中才能找到一个可用位点,这大大限制了使用范围。
我国在CRISPR/Cas9临床应用中处于国际领军地位。2015年4月22日,《自然》杂志披露,广州中山大学基因功能研究员黄军就的研究团队利用CRISPR/Cas9技术,试图修改人类胚胎中编码人β-珠蛋白的HBB基因,该基因的突变可能导致地中海贫血症。论文在发表在《Protein & Cell》杂志上。哈佛大学干细胞生物学家乔治•戴利表示,这是世界上首例运用这一技术修改人类胚胎基因的尝试,是个里程碑。同时,黄军就也因此入选Nature2015年十大人物,也充分表明我国在这一领域的国际领军地位。

CRISPR的应用:横跨干细胞、育种,重新定义代谢性疾病、疟疾、艾滋病领域的治疗
CRISPR/Cas9的应用领域:干细胞治疗、育种等多领域将迎来新突破。正是由于这些革命性的特征,CRISPR-Cas9系统显示出了其巨大的应用潜力:1)在基础科学研究领域,CRISPR-Cas9系统最多的是被用来定点敲除一些基因,从而便于研究这些基因的生物学功能。同时CRISPR-Cas9系统的商业化应用潜力也不容小视,主要体现在:2)在改写人类基因方面:结合诱导多能干细胞(iPS)技术,人们可以将通过基因编辑修复的iPS细胞重新发育为正常组织和器官来供病人使用;3)在家畜育种等工作中,对一些关键性状基因的编辑能够大大加快良种的育种速度。
改写人类基因:重新定义代谢性疾病、疟疾、艾滋病领域的治疗。不像其他基因编辑手段,它使用起来廉价、迅速且简单,并因此席卷全球的顶尖大学、研究院以及医疗生物企业实验室。同时,相对运用于人类生殖/胚胎细胞的伦理限制,但是基因编辑用于人类体细胞的缺陷基因改造在法律上没有任何限制,这方面去年以来CRISPR/Cas9已有的成功临床运用包括:
去年,麻省理工学院生物工程学家在小鼠身上利用CRISPR修正了一个同人类代谢性疾病相关的突变tyrosinaemia。这是首次利用CRISPR在成年动物体内修正致病突变,是将该项技术用于人类基因疗法的一个重大进步。
另外一批美国科研人员利用CRISPR-Cas9基因编辑技术,对蚊子的基因进行改造,使其携带一种抗疟疾的基因,从而对疟原虫产生抑制,进而遏制疟疾的传播。同时,CRISPR在治疗艾滋病方面也被证实非常有效,美国研究人员针对艾滋病病毒潜伏的多种细胞模型进行实验,比如小胶质细胞、T淋巴细胞等,利用CRISPR-Cas9基因组剪辑技术,将艾滋病毒从艾滋病患者的细胞基因组中剔除,实验结果证实,艾滋病病毒均被清除。

重塑动物:“造物主”之梦不再遥远。基因编辑技术可以为动物塑造出任何人类想要的性状,能够彻底颠覆动物育种界已有认知,在养殖业具有重大应用前景。已经接受基因改良的动物包括苍蝇、蠕虫、白鼬甚至是猎兔犬(我国对其进行基因改造,使其变得十分强壮)。一项值得引起关注的项目是初创公司动物生物科技公司(Recombinetics)对乳牛进行基因改造,使它们不长出牛角。
工程植物:五年内首批基因编辑食物将端上餐桌。这是农业巨头争相涉足基因编辑领域,缺乏监管是这一领域最大特点。例如,具有除草剂抵抗力的玉米。 但基因编辑马铃薯。杜邦公司(DuPont)是最大的转基因作物销售公司之一,认为首批基因编辑食物将会在五年内被端上餐桌。
他山之石:海外专注于基因编辑技术的生物科技初创公司
最近几年,一些医药科技公司公司如雨后春笋般出现,开发基于CRISPR的基因疗法,此类疗法的首次临床试验会在接下来的一到两年内进行。这些首批试验或许将勾勒出CRISPR的应用场景,即CRISPR成分能被直接注入眼睛等器官,或者细胞能从人体移除并在实验室中进行基因改造后被放回体内----形成血液的干细胞可能被修正用于治疗诸如镰状细胞性贫血症或β-地中海贫血等疾病。今年8月,包括比尔及梅林达•盖茨基金会和谷歌风投基金在内的重量级投资者,拿出1.2亿美元投资马萨诸塞州剑桥的Editas医药公司。大农业投资也在跟进,杜邦在10月和加州伯克利的Caribou生物科学公司达成了合作协议,宣布将使用Crispr-Cas9技术来改进作物。下面我们来看一看美国的在这一领域的领先的生物医药公司。
Caribou Biosciences:全球首家基因编辑公司,专注技术提升
公司及创始人简介:Caribou Biosciences 成立于2011 年 10 月,是在研究并将CRISPR基因编辑技术应用于临床医学领域的第一家新兴生物科技公司。公司的创始人是加州伯克利分校的教授詹妮弗•杜德娜和她的博士学生蕾切尔•哈维茨,前者是CRISPR技术的发明者之一。

核心技术及领域:Caribou 公司与和之后相继成立的其他的CRISPR生物技术公司不同,它是这些新兴公司中唯一一家没有集中精力研发人类疾病治疗方法的公司。相反,它主要专注于提升基因编辑技术的质量,创造工具让这一技术更加可靠,使其在整个行业、而非仅仅是医药领域发挥更大的作用。
主要融资方式:2014 年,一个由硅谷精英资助的小组(谢尔盖•布林和马克•扎克伯格也是资助人之一)把生命科学领域突破奖颁给了詹妮弗•杜德娜和她的一位合作者——瑞士的艾曼纽•卡彭特,以奖励她们在发明CRISPR技术的成就,并且奖励他们每人三百万美金。2015年,詹妮弗•杜德娜被《时代》杂志列为2015年度全世界最具影响力的100人之一。
Editas Medicine: CRISPR技术发明人团队,2017年开启肿瘤免疫及先天黑内障试验
公司及创始人简介:Editas 是一家2013年11月成立的专门从事于将CRISPR/Cas9 和TALEN技术应用到基因编辑、蛋白质工程和分子与结构化生物的创投公司。公司的创始人均是来自美国哈佛大学与麻省理工大学的在CRISPR/Cas9领域的世界顶级科学家,其中包括来自麻省理工Broad研究所的张峰和加州伯克利分校的詹妮弗•杜德娜,他们俩是CRISPR/Cas9技术的发明者。在今年4月,张锋和Broad研究所获得了CRISPR相关的首个专利,专利权包括除细菌外的任何生物,既真核细胞或者任何细胞有细胞核的物种中(如老鼠、猪、牛和人)使用CRISPR的权利。
融资方式:2013年公司成立时,获得了4300万美元的第一轮风险投资,投资者包括Third Rock Ventures 、Polaris Partners和 Flagship Ventures。今年8月公司获得了1.2亿美元的第二轮融资,融资投资者包括微软联合创始人比尔•盖茨、谷歌、Deerfield Management和Fidelity Management & Research。
核心技术及专注领域:不久前,在CAR-T疗法治疗肿瘤疾病的新兴医疗公司Juno Therapeutics与Editas Medicine达成协议,利用后者的CRISPR技术,共同开发癌症免疫疗法CAR-T和TCR(high-affinity T cell receptor)。根据协议,Juno同意支付Editas 2500万美元的预付款以及额外2200万美元的研究投资,用于支持合作的3个项目。对于每个项目,Juno还同意支付2.3亿美元的里程碑付款。总计,这项合作将为Editas带来7.37亿美元。
Editas公司CEO Katrine Bosley今年举行的EmTech会议上表示,该公司计划在2017年开启CRISPR治疗一种罕见的失明性疾病的临床试验,这种疾病名叫眼疾雷伯氏先天性黑内障,雷伯氏先天性黑内障患者天生只能看到大且明亮的物体,他们的视力低下到与失明无差异。
Editas计划以CRISPR作为此次基因疗法的核心技术。此次治疗将携带CRISPR组件的DNA病毒载体注入视网膜中,同时还包含一个能精准切割基因的蛋白。Bosley表示在进行人类试验之前Editas仍需要在实验动物体内进行大量的测试。如果Editas执行该计划,那么这项研究将是CRISPR编辑人类DNA的首个例子。

Intellia Therapeutics:专注CRISPR/Cas9技术在CAR-T细胞治疗和造血干细胞中的应用
公司及融资简介:Intellia Therapeutics也是一个专门从事将CRISPR/Cas9 技术应用于临床医学来治疗遗传性疾病的新兴医药科技公司。Intelli的联合创始人是从Iditas离职的创始人Jennifer Doudna。公司成立于2014年11月,初期获得了1500万美元A轮融资,投资者包括在CAR-T治疗领域的新兴医药公司诺华(Novartis)和风投公司Atlas Venture 。今年六月公司完成了7000万美元的B 轮融资,投资者包括由 OrbiMed HealthCare Fund Management, Foresite Capital等基金。
公司核心技术及专注领域:2015年1月,医药公司诺华宣布与Intellia Therapeutics展开一项长达 5年的研发合作计划,诺华将会把CRISPR技术应用到自己的免疫疗法项目----嵌合抗原受体T细胞免疫疗法(CAR-T)中。该疗法首先将病人的T细胞通过CRISPR技术在体外进行基因编辑,然后重新输入病人体内,这些被修饰过的T细胞会识别并攻击肿瘤细胞,最后达到清除癌细胞的目的。
除了免疫疗法领域,两公司在也计划共同致力于加速发展CRISPR/Cas9技术在CAR-T细胞治疗和造血干细胞中的应用利用,以治疗造血干细胞相关的疾病,包括镰状细胞病、β-地中海贫血。Intellia的CEO和联合创始人Nessan Bermingham博士表示,Intellia与诺华的合作将会极大地推动将CRISPR/Cas9转化为实际治疗手段的应用,CAR-T和造血干细胞治疗是CRISPR/Cas9技术极具代表性的应用领域和契机,而诺华毫无疑问是这两项治疗领域的领跑者,与诺华合作可以加速发展产品的研发。为了增加Intellia持有的股权,诺华向intellia支付了预付款,并且为未来5年的合作提供了技术支持和研发费用。Intellia也将有资格获得后续研发成功的报酬和专利费。
Intellia Therapeutics 未来的发展方向是将 CRISPR 与 CAR-T 更好结合。Intellia Therapeutics 的 CRISPR 技术”与“诺华的 CAR-T 细胞疗法” 组合起来将会是黄金搭档,在很多基因治疗的应用领域都展现出极大的应用前景,例如血液病、肿瘤等其他遗传性疾病。

Sangamo:有望打开艾滋病治疗的“新天地”
公司简介:Sangamo(SGMO)生物医药公司成立于1995年,于2000年在纳斯达克交易所上市,交易代码为SGMO。该公司是一家专注于研究和发展应用在治疗遗传性和感染性疾病的锌指核酸结合蛋白工程(ZFP)的临床阶段的生物医药公司。公司自有的锌指核酸结合蛋白科技平台在全世界处于领先地位,该科技平台能够实现非常精准的基因表达和基因组修改。
核心技术及专注领域:Sangamo公司正在进行一种使用锌指核酸结合蛋白来治疗艾滋病的临床试验,该药物叫做 SB-728,这种治疗方法使用基于锌指蛋白核酸内切酶的基因编辑技术,复制人体体内自然突变产生的能够抵抗HIV病毒突变基因。Sangamo使用基于锌指蛋白核酸内切酶的基因编辑技术来扰乱艾滋病患者体内免疫系统的CCR5基因,使这些细胞能够对HIV病毒感染产生永久性的抵抗能力。CCR5基因是HIV病毒进入体免疫T细胞的感应器之一,如果CCR5没有表达,那么HIV感染的效率会大大降低。
Sangamo研发的第一款抗艾滋病药物叫“锌指蛋白内切酶-CCR5-修改”的T细胞产品(SB-728-T),目前该药物正处于对HIV患者的第II阶段的评估过程中。另一款药物叫“锌指蛋白内切酶-CCR5-修改”的干细胞产品(SB-728-HSPC),它使用电击法传导锌指蛋白, 该药物处于第I期临床试验。

几点启示
通过对这些海外最为先进的CRISPR/Cas9公司创始情况、融资方式、核心技术、应用领域、在研产品等方面的梳理,我们可以得出如下结论:
第一,第三代基因编辑技术CRISPR/Cas9自诞生之日起就深度与产业化、商业化相结合,这意味着其后续大规模应用的速度将超出想象。通过梳理上述四家公司创始人团队,我们看到,CRISPR/Cas9技术的两大发明人麻省理工Broad研究所的张峰和加州伯克利分校的詹妮弗•杜德娜,分别担任了全球首家基因编辑公司Caribou Biosciences和Editas的创始人,这意味着第三代基因编辑技术的产学研的零阻隔。
第二,全球最先进的产业资本对于第三代基因编辑技术CRISPR/Cas9投入不计成本,这意味着其巨大的应用前景及市场空间已得到全球公认。通过梳理上述四家公司融资方式可以看出,尽管上述四家公司大多数产品仍处于试验阶段,业绩落地尚需一定时日。然而,包括谷歌、微软、马克•扎克伯格在内全球最前沿“创投”资本以及包括诺华在内的医学产业资本均不惜重金投入上述基因编辑公司的每一轮融资,一方面显示了该技术的巨大前景,另一方面,这些先进产业资本的动向本身就是资本市场的“风向标”。
第三,艾滋病、癌症是应用的最重点领域,CRISPR获得高度关注的背后是其可以与造血干细胞治疗、CAR-T肿瘤细胞治疗等深度结合提供快速商业化方案。从应用领域看,我们列举的四家最顶尖基因编辑公司中除了专注于技术基础研究的Caribou Biosciences外,其余三家公司Editas,Intellia,Saangamo均不约而同的将重点放在了肿瘤及艾滋病治疗领域,表明这两大领域将是CRISPR的应用的重点;此外,从技术使用方面,CRISPR 与 CAR-T肿瘤治疗以及造血干细胞分化诱导的更好的深度结合是最重要发展方向,这意味着基因编辑技术有望成为精准医疗的核心,使精准医疗真正大规模商业化成为可能。
第四,从各家公司在研产品看,2016-2017年有望药品集中上市、重大临床试验集中展开。从2012年CRISPR技术被首次研发算起,不到三年时间,重点商业化公司及临床治疗方案便如雨后春笋般展开,这种速度在生物医学领域是不多见的。同时,从在研产品看,各家公司对于2016-2017年基因编辑产品的集中上市是有明确时间表的,如:Sangamo研发的第一款抗艾滋病药物叫“锌指蛋白内切酶-CCR5-修改”的T细胞产品(SB-728-T),正处于临床二期,未来1-2年有望进入三期;Editas计划在2017年开启CRISPR治疗一种罕见的失明性疾病的临床试验。这些在研产品试验的集中展开,将引起全球的持续高度关注。
今年12月1日到3日在华盛顿举办的基因编辑国际峰会为基因编辑技术的基础研究和临床医学发展打下了一针强心剂:此次会议对人类基因编辑领域的基础和临床前期研究的必要性和重要性提出了积极的肯定,扫除了以违反伦理道德为由而反对在人类生殖或胚胎细胞进行基因编辑的基础和临床前期研究的声音。对于在人类体细胞上的基因编辑的临床医学试验积极地肯定了基因编辑技术对治疗遗传性疾病的巨大优势,这将会积极鼓励医疗科技行业加大对基因编辑技术的应用于商业化的投入,在未来几年内,那些专注于使用基因编辑技术治疗遗传性疾病的生物医学科技公司将会从他们所取得的临床医学成果中获得巨大的回报。
资本市场的思考:基因编辑迎来内外催化“双驱动”的“爆发时代”
主题短期强催化:Science+Nature年度头号突破+华大上市+精准医疗基金 ,基因编辑主题有望复制量子通信行情
2015年头号科技突破+华人领军,基因编辑短期有望迎来“最强风口”。1)12月18日晚,美国《科学》杂志公布了其评选的2015年十大科学突破,被业内誉为“基因剪刀”的CRISPR基因组编辑技术当选今年头号突破,《科学》杂志执行新闻编辑约翰•特拉维斯说,这是一个“前所未有的选择”,因为这项技术过去两次入选《科学》年度十大突破,今年“晋升”到头号突破;2)与此同时,12月18日,黄军就入选Nature 2015年十大人物,彰显出我国在这一领域的领军地位。
全球顶尖荣誉“抓眼球”+我国科学家登顶“接地气”,基因编辑短期有望复制量子通信行情。作为短期主题投资,最重要的是:1)主题广阔的想象空间带来的不可证伪性,这其中全球顶尖科技奖项的登顶是科技类主题“吸引眼球”的最好催化;2)这其中,如果我国在这一领域若占据领先地位,则易引起资本市场对于后续政策扶持持续加大的预期,这其中,若我国科学家登顶全球最高科技奖项,则是“接地气”的最好催化。
近两周以来量子通信主题的大涨是上述逻辑淋漓尽致的展现,然而,我们认为,相对量子通信主题无论从“抓眼球”-顶尖荣誉的层次(Science 2015年全球“前所未有”头号突破 vs《物理世界》国际物理学领域的重大突破);“接地气”-国内科研在该领域的地位(黄军就团队荣获Nature 2015年十大人物);政策的持续扶持力度(精准医疗不仅有望成为上升“十三五”重大科技专项,而且第一时间受到习总高度关注,且已明确投入600亿元)以及不易证伪性(相对量子通信不易落地,CRISPR基因组编辑可以快速、廉价大规模推广开启基因工程平民化新时代)都要优于量子通信主题,且精准医疗主题个股近半年来相对“沉寂”,我们认为,此次国际最重要奖项的两重登顶,将为该滞涨的成长性洼地带来“强风口”。

短期另外两项重磅催化:华大基因上市+首个精准医疗指数基金发行。据证监会12月18日预披露华大基因招股说明书,这表明精准医疗领域国内绝对龙头华大基因上市在即。公司在产品布局方面覆盖精准医疗各个子环节:从干细胞治疗、基因测序、基因治疗,且技术方面居于国内绝对龙头,堪称精准医疗的航空母舰,其上市势必对整个精准医疗板块产生强催化。
另外,12月17日,汇添富中证精准医疗主题指数型发起式证券投资基金(LOF)招募说明书。这表明首个精准医疗指数型基金发行在即。考虑到指数基金被动配置的特点,我们预计整个精准医疗板块所有公司,特别是小市值公司都将受益。
主题内生技术催化:基因工程大规模商用化+国际资本持续运作+明后年药物试验集中上市+规制确定
技术角度:基因工程大规模商业化“平民化”的“技术拐点”或到来。更本质地看,我们认为与其他更靠近基础科学的科技前沿主题难以落地不同,本次备受瞩目的的第三代基因编辑技术CRISPR最大贡献在于通过其高安全性、高效、廉价、简易的特点,能够快速被普通企业与中小实验室采用,开启了基因工程“平民化”的新时代。其恰似一把关键的钥匙,将原本应用前景及想象空间无限但受制于成本及技术的一系列基因工程技术——干细胞诱导、肿瘤免疫治疗、小核酸-基因治疗等,快速大规模的推向普通中小实验室。从这个意义上说,我们认为,第三代基因编辑技术实际上标志着整个基因工程-精准医疗从概念期向大规模应用爆发的“技术拐点”的到来,这是我们坚定看好精准医疗-基因编辑的根本原因。
规制角度:华盛顿基因编辑国际峰会“研究-伦理”共识已达成,后续各国持续加码将成大概率事件。今年12月1日到3日在华盛顿举办的基因编辑国际峰会为基因编辑技术的基础研究和临床医学发展打下了一针强心剂。由于CRISPR/Cas9技术大大降低了基因编辑的门槛,使得基因编辑的资金门槛和技术门槛都降低到了可以普及大众的地步,而且这种革命性的变化非常的快,因此各国的监管体系并没有及时的跟进,相关的法律法规严重滞后。科学家们亟需在这一领域的基础性与临床性研究的“绿灯区”和“禁区”达成共识,这将不仅会减少科学研究的伦理道德争议,也将会给未来的监管法规的设立提供指引。
此次会议对人类基因编辑领域的基础和临床前期研究的必要性和重要性提出了积极的肯定,扫除了以违反伦理道德为由而反对在人类生殖或胚胎细胞进行基因编辑的基础和临床前期研究的声音。对于在人类体细胞上的基因编辑的临床医学试验积极地肯定了基因编辑技术对治疗遗传性疾病的巨大优势,我们预计,在伦理问题明确后,一方面,将积极鼓励医疗科技行业加大对基因编辑技术的应用于商业化的投入,在未来几年内,那些专注于使用基因编辑技术治疗遗传性疾病的生物医学科技公司将会从他们所取得的临床医学成果中获得巨大的回报;另一方面,各国政府对于该技术的态度或将更进一步转向积极支持,考虑到其巨大应用前景,预计后续各国一系列扶植政策或将出台。
国际先进资本的持续投入及新品试验的集中进行将在未来1-2年为资本市场带来持续催化。通过上文对海外先进基因编辑公司的梳理,我们看到:一方面,一些医药科技公司公司如雨后春笋般出现,开发基于CRISPR的基因疗法,此类疗法的首次临床试验会在接下来的一到两年内进行。这些首批试验或许将勾勒出CRISPR的应用场景,如CRISPR成分能被直接注入眼睛等器官,或者细胞能从人体移除并在实验室中进行基因改造后被放回体内等。另一方面,国际最先进产业资本对基因编辑的持续投入不计成本,今年8月,包括比尔及梅林达•盖茨基金会和谷歌风投基金在内的重量级投资者,拿出1.2亿美元投资马萨诸塞州剑桥的Editas医药公司。大农业投资也在跟进,杜邦在10月和加州伯克利的Caribou生物科学公司达成了合作协议,宣布将使用Crispr-Cas9技术来改进作物。
更大背景的思考:精准医疗在2016年将迎来中、美、欧“多重奏”
我们在《全球“多重奏”之下,“精准+肿瘤”助力干细胞腾飞!——干细胞治疗深度报告》中就已经明确指出,我们看好干细胞治疗在2016年爆发的主要逻辑,除了基本面上广阔的应用前景外,更重要的是其在2016年将面临全球及国内多重催化剂的持续“共振”:1)从美国看,“FDA III期+大选政治周期”将使得奥巴马政府进一步加码包括干细胞治疗、精准医疗在内的高端生物医药成为大概率事件;2)从欧洲看,首个干细胞药物大概率获批上市将带来示范效应,同时,参考工业4.0各国政策加码经验,欧洲版精准医疗方案也有望继中、美后推出;3)从国内政策看,今年的干细胞放开只是第一步,后续的看点至少有三个,包括:商业化及临床化治疗的放开、质控与疗效评价标准的明确以及异体干细胞治疗的放开,此外,精准医疗成为十三五重大科技专项,上升国家战略也将带来强催化。
我们认为,作为精准医疗大规模商业化的关键技术——第三代基因编辑CRISPR,一方面助推精准医疗商业化快速推进,另一方面,也将共享上述“多重奏”下持续“风口”的“盛宴”。
投资建议新思考
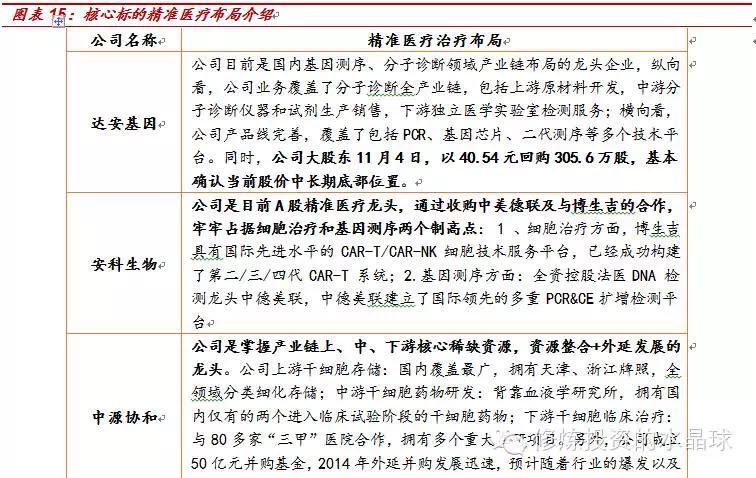
在《全球“多重奏”之下,“精准+肿瘤”助力干细胞腾飞!——干细胞治疗深度报告》中我们强调看好全产业链布局类公司,并认为干细胞与精准医疗肿瘤免疫相结合的公司短期弹性更大,事实证明,我们的判断较为精准。考虑到本周末一系列重磅催化:Science+Nature年度头号突破+华大上市+精准医疗基金,在精准医疗大主题中,基因-细胞免疫治疗子方向将直接受益第三代基因编辑CRISPR的重大突破,是短期最具爆发潜力的子方向,我们强烈推荐关注该方向下的“四小龙”:达安基因、安科生物、中源协和、新开源。


-
 游客2015-12-31 01:02:53m
游客2015-12-31 01:02:53m
 正在加载
正在加载 腾讯登录
腾讯登录