揭秘!肠道菌群中的“一类致癌物”是如何逃过免疫检测?
| 导读 | 尽管幽门螺杆菌可诱导炎症反应,但其仍可以刺激胃粘膜数十年。 幽门螺杆菌表达的胆固醇-α-葡萄糖基转移酶(由cgt编码)是其定植和T细胞活化所必需的。研究人员研究了cgt如何影响胃上皮细胞和宿主免疫反应。 |
胃细菌幽门螺杆菌定居于世界大约一半人口的胃中,并可导致胃癌的发生。尽管胃粘膜有炎症防御反应的产生,这种防御机制通常在儿童时期获得并持续终生。这种炎症通常是有益的,因为它可杀死入侵的病原体。然而就幽门螺旋杆菌而言,炎症从未消除该入侵者,而是允许其存在持续数十年 。 这是溃疡和癌症发展的主要原因。

尽管许多持续存在的细菌依赖于预防免疫检测,但在急性炎症中持续存在对于病原体来说是不同寻常。迄今为止,螺杆菌如何能够做到这一点已经完全不清楚。现在柏林Max Planck感染生物学研究所的研究人员发现,通过从宿主细胞膜中提取胆固醇,幽门螺杆菌分解了组装干扰素受体所需的重要组分。这些细胞因子是将适应性免疫系统召集到受感染的粘膜的关键信号分子 ,并且它们的缺失使细菌能够得以存活,而炎症在周围区域却继续不减。
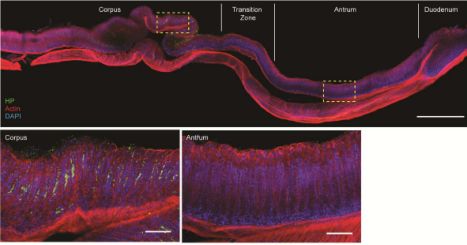
原代胃黏膜培养技术
虽然胃炎和胃溃疡病曾经被认为是压力和饮食因素引起的,但在20世纪80年代发现,真正的罪魁祸首是感染了一种细菌-幽门螺旋杆菌。这种病原体现在被WHO分类为I型致癌物,因为它是胃癌发展的主要危险因素。尝试开发针对幽门螺旋杆菌的疫苗尚未成功,新的结果为这些失败提供了第一个潜在的解释:幽门螺杆菌阻断了让感染细胞从免疫系统中获得帮助的信号。
Thomas F. Meyer实验室在十多年前已经发现。幽门螺旋杆菌表达一种称为胆固醇-α-葡糖基转移酶的酶来从宿主细胞中提取它所需的胆固醇。没有这种酶的存在,细菌不能感染小鼠。当时,该小组还注意到,小鼠饮食中过量的胆固醇提高了病原体的清除率,但加剧了炎症。究竟如何提取胆固醇与免疫逃避的关系尚不清楚。
现在,用于体外培养原代胃细胞的新技术有助于解决这个难题。Meyer的实验室成功地重建了胃粘膜上皮,产生了所谓的“粘膜”,其中胃细胞作为具有外表面和内表面的单层生长,甚至产生排列并保护胃的粘液。同时,受感染的“小型器官”可以持续存在数月。
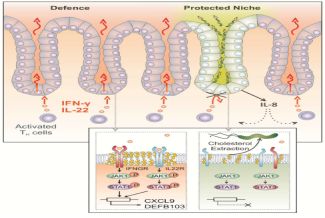
脂筏的形成及其相关免疫系统的激活
脂筏形成需要胆固醇
感染的胃上皮细胞通常聚集免疫细胞并产生杀灭细菌的抗微生物因子。该反应取决于由上皮细胞产生的关键免疫信号因子:干扰素-γ。通过使用粘膜模型,该组发现细菌在细胞顶部作为小的微集落存活。原来,这是由于细胞膜中没有所谓的“脂筏”,这是装配干扰素受体复合物所需的。没有这些,宿主细胞完全不响应干扰素-γ。脂筏由胆固醇制成,并且它们的破坏由细菌的胆固醇-α-葡糖基转移酶介导。
“研究幽门螺旋杆菌如何在急性炎症中持续存在,解释了一系列观察结果,并使我们以全新的视角思考感染的状况”,第一作者Pau Morey说道。开发这种新的体外模型的Francesco Boccellato补充道:“粘膜能够对长期稳定的感染进行研究,并且将成为研究粘膜感染,粘膜防御和癌症出现的潜在机制的宝贵工具”。
参考文献
Pau Morey, Lennart Pfannkuch, Ervinna Pang, Francesco Boccellato, Michael
Sigal,Aki Imai-Matsushima,Victoria Dyer,Manuel Koch,Hans-Joachim Mollenkopf, Philipp Schlaermann, Thomas F. MeyerHelicobacter pylori Depletes Cholesterol in Gastric Glands to Prevent Interferon gamma Signaling and Escape the Inflammatory Response
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发