《Cell》子刊来告诉你: 如何从基因水平做到肺癌的个体化治疗
| 导读 | 点击上方“转化医学网”订阅我们!干货 | 靠谱 | 实用 导 读在本期的Cancer Cell中,对肺癌 |

在本期的Cancer Cell中,对肺癌治疗的研究有了新进展,Hellmann等人在两项临床试验中描述了肿瘤突变负荷(TMB)作为独立预测性标记物的重要特征,从而预测出将nivolumab联合ipilimumab作为转移性非小细胞肺癌和复发性小细胞肺癌的一线治疗的效果。这是癌症在基因水平的又一突破。
最近几年,免疫治疗在肺癌的治疗领域拔得头筹,而PD-1/L1更是被看做是“抗癌神药”,然而由于患者的个体差异等,并不是每名肺癌患者都适合联合免疫治疗。那怎样才能更有效地确定患者的治疗方案呢?TMB提供了进一步的临床研究方向。

最新发现,通过涉及细胞毒性T淋巴细胞相关蛋白4(CTLA4)或程序性死亡(配体)1(PD- L1)的抑制途径,癌细胞能够抑制免疫系统,从而导致在严格控制的条件下,保留预先存在的具有特异性T细胞反应机制的抗体。这些免疫检查点抑制剂极大地改变了针对各种转移性实体瘤患者的传统观点。
迄今为止,免疫检查点抑制剂已被批准用于黑色素瘤,非小细胞肺癌(NSCLC),Merkel细胞癌,透明细胞肾细胞癌,膀胱癌,头颈部鳞状细胞癌,和任何组织亚型的微卫星不稳定性高肿瘤。这些治疗最相关的观察结果是它们能够在一部分患者中提供长期的肿瘤控制。在NSCLC的第一阶段nivolumab试验的随访中显示只有少数患者长期受益。
在接受预先治疗的小细胞肺癌(SCLC)患者中,单独使用nivolumab并联合ipilimumab仅使RR(相对危险度)增加10%和25%,表明与NSCLC相比活性较低。根据国家综合网络指南,由于观察到长期的疾病控制效果,nivolumab±ipilimumab目前被推荐用于难治性SCLC患者。
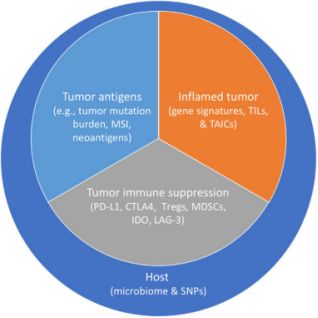
癌症是由体细胞突变的累积引起的。非同义突变可能引起MHC在恶性肿瘤细胞表面表达的新抗原,偶尔引发恶性细胞的T细胞依赖性排斥反应。肿瘤突变负荷(TMB)由每个基因组区域的体细胞突变数决定。
TMB在肿瘤中的变化很大,范围从每兆碱基0.001至400多个突变。 NSCLC和SCLC表现出高突变率,可归因于广泛接触烟草烟雾。非同义突变和新抗原负荷升高均与黑素瘤对ipilimumab的反应有关,更高的TMB与抗PD1治疗对NSCLC具有更大益处。
研究发现,,通过全外显子组测序(WES)测量的高TMB,可观察到 nivolumab±ipilimu-mab在NSCLC或SCLC患者中具有更明显的疗效。这些结果证实了TMB作为免疫治疗的独立生物标志物的重要性,正如在其他肿瘤类型包括黑色素瘤,肾脏,尿路上皮,胃癌,结肠直肠癌和胶质母细胞瘤中所证实的那样。
另一方面,对于低TMB的患者来说,联合治疗并没有比nivolumab单药治疗更有利于生存。在非小细胞肺癌患者中,TMB在患者中较高表达,具有高反应性和持久性的临床益处。 PD-L1表达和TMB与RR和无进展生存期独立相关,5例PD-L1阴性和TMB高度肿瘤患者中有4例有反应。
这些发现表明,TMB和PD-L1检测可能在将来以不同NSCLC治疗系中存在多种免疫治疗选择的临床情况下以互补方式使用;此外,包括免疫疗法单一疗法和免疫疗法/化疗和免疫治疗/免疫疗法组合在内的各种方法正在成为新的治疗选择。目前,把TMB结合到肺癌基因组测序中,可给临床医生和患者最全面最有价值的精准治疗指导。
参考文献:
Antonia, S.J., Lo´ pez-Martin, J.A., Bendell, Genomic Features of Response to Combination Immunotherapy in Lung Cancer
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发