Science:突破!新法让癌细胞无处可逃!阻断肿瘤免疫抑制!
| 导读 | 肿瘤细胞可通过许多途径逃脱免疫系统的识别和清除,其中最为出名的便是今年斩获诺贝尔医学或生理学奖的PD-1与PD-L1的相互作用。虽然抗PD-1药物已经上市,但研究人员仍在探索不同的肿瘤免疫逃避机制。 |
肿瘤细胞可通过许多途径逃脱免疫系统的识别和清除,其中最为出名的便是今年斩获诺贝尔医学或生理学奖的PD-1与PD-L1的相互作用。虽然抗PD-1药物已经上市,但研究人员仍在探索不同的肿瘤免疫逃避机制。来自来自UCLouvain、WELBIO、VIB和根特大学的研究团队对抑制免疫细胞的关键蛋白进行了三维结构解析,阐明了这些蛋白质在细胞中如何被准确组装,同时,还阐明了抗体如何阻断这一组装过程。其研究的最新进展发表于近期的《Science》杂志。

TGF-β蛋白通过一系列相互作用影响免疫抑制过程
Tregs(调节性T淋巴细胞)是免疫抑制细胞,通常抑制过度的免疫反应以确保机体不会产生自身免疫性疾病。但在肿瘤患者中,它们可通过降低对肿瘤细胞的免疫反应从而发挥促进了肿瘤的免疫逃逸。 Tregs通过产生一种称为TGF-β的蛋白质信使来发挥其降低肿瘤免疫效能的作用。该信使将抑制信号传递给附近的免疫细胞,特别是那些对肿瘤有强力杀伤效应的免疫细胞。
Tregs产生TGF-β的方式复杂但又被精准调控,其产生的TGF-β活性十分高,因此这种蛋白的合成分泌过程受到严格的调控。
三年前,Sophie Lucas教授和她在UCLouvain de Duve研究所的研究小组发现,Treg表面上存在的一种名为GARP的蛋白质,这种蛋白质对TGF-β分泌释放至关重要。与生物公司argenx合作后,她的团队发现可以用特异性抗体阻断GARP,进而阻断TGF-β的释放,但这种抗体很罕见且又很难获得。紧接着他们细致的研究了GARP是如何调节TGF-β信使的产生以及抗体如何阻断其释放。
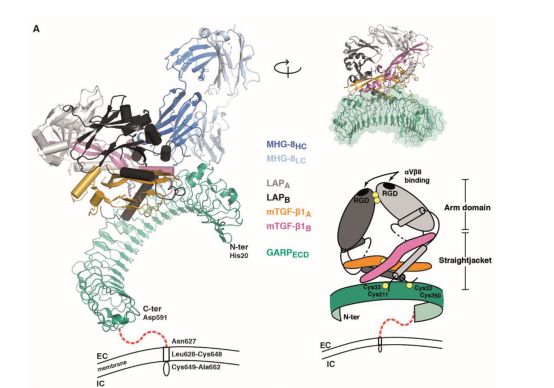
阐明GARP与TGF-β的分子机制
为解决这些问题,Sophie Lucas和argenx在VIB-UGent炎症研究中心与Savvas Savvides教授的团队展开合作,共同分析GARP和TGF-β蛋白质组装的三维结构。研究人员使用X射线晶体学对这些分子进行分析。然而,他们无法轻易获得GARP和TGF-β复合物的晶体。
由UCLouvain和Romain Merceron VIB-Ghent大学组成的研究团队决定使用阻断抗体来维持和稳定底物结构,这一方法不仅有助于产生用于结构测定的晶体,还能够阐明治疗性抗体是如何发挥作用的。
Savvas Savvides教授表示,“他们发现GARP分子像马蹄铁一样连接于TGF-β,而TGF-β本身有助于GARP马蹄形结构的形成。抗体的片段在其组装过程中粘附在GARP和TGF-β的表面。
它似乎将两个分子相互粘合在了一起,确保当其他分子拉动组件的任一一部分时,TGF-β不会被释放,进而导致其无法传达其抑制信息”。Sophie Lucas教授表示,“这种大分子组装的可视化表明阻断和限制的细胞源性(如Tregs表面)的TGF-β可大大改变整个免疫活性。
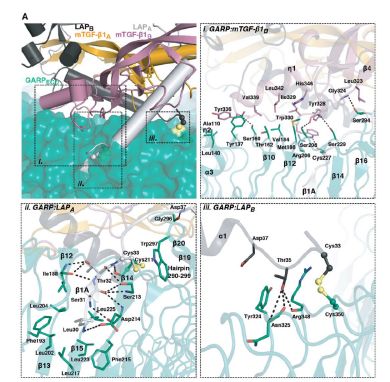
研究人员表示,他们接下的工作将研究如何利用抗体对GARP和TGF-β的阻断作用对现有肿瘤免疫疗法产生有益的作用。这一研究成果也将吸引其他研究者对这一分子作用做进一步的基础研究和临床应用开发。
参考文献:
Savvas Savvides, Sophie Lucas.Structural of basis of latent TGF-βpresentation and activation by GARP on human regulatory T cells
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发