《PNAS》:肿瘤发生过程中p27“神奇”的双重作用
| 导读 | 肿瘤发生过程的明星分子p27又有新进展!先前的研究多集中于p27作为CDK分子的抑制剂,但此次最新的研究发现,当PI3K激酶磷酸化时,p27从CDK抑制剂可转变为诱导肿瘤发生的致癌基因。 |
肿瘤发生过程的明星分子p27又有新进展!先前的研究多集中于p27作为CDK分子的抑制剂,但此次最新的研究发现,当PI3K激酶磷酸化时,p27从CDK抑制剂可转变为诱导肿瘤发生的致癌基因。此次,来自迈阿密大学米勒医学院Joyce M. Slingerland教授率领的研究团队研究发现,p27分子是c-Jun分子的共调节因子,其组装和染色质结合由p27的磷酸化决定。这些作用凸显了p27分子在肿瘤发生与防治的中的“双重”作用 。这一发现发表于最新的《PNAS》杂志。

CDK抑制剂p27可通过转化生长因子β(TGF-β)介导肿瘤生长的抑制分子,其通过抑制细胞周期蛋白依赖性激酶(CDK)来阻止细胞周期进展。 p27在人类癌症中呈现失调状态,但其与典型的肿瘤抑制因子不同,编码p27的CDKN1B基因的突变或缺失十分罕见。 p27可通过过量蛋白水解,减少翻译或C末端磷酸化在癌症中发挥功能性破坏作用。
磷脂酰肌醇3-激酶(PI3K)通路在大多数人类癌症中通过激活受体酪氨酸激酶、PI3K成分及效应激酶或失去其负性调控分子被激活。 PI3K活化的激酶在T157和T198两个位点磷酸化p27分子。 p27核定位信号中T157处的磷酸化可导致核输入延迟,而T198磷酸化则可稳定蛋白质,这导致p27在细胞质中逐步积累。 值得注意的是,高达60%的乳腺癌表达激活的pAKT,这与检测核和细胞质p27以及通过免疫组化分析检测到的p27pT198密切相关。
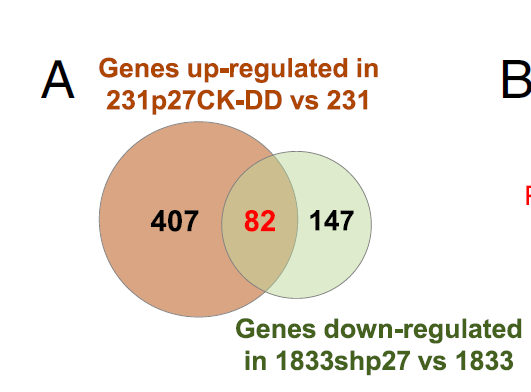
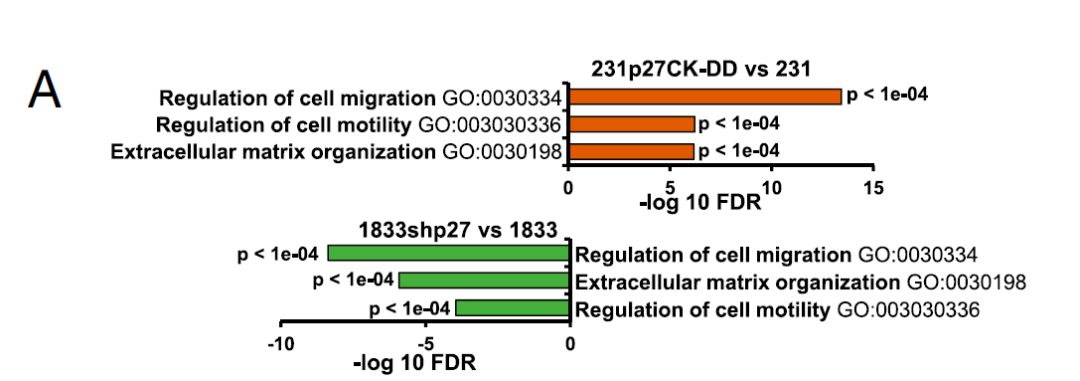
此次来自迈阿密大学米勒医学院Joyce M. Slingerland教授率领的研究团队研究发现了PI3K和c-Jun途径之间的协同作用:PI3K激活的激酶可使p27磷酸化,进而刺激p27 / c-Jun染色质再招募,激活肿瘤细胞粘附、运动,TGFB2和上皮 - 间充质转化的转录程序的起始,最终驱动整个肿瘤的进展。 先前的分析表明,高p27pT157与人乳腺癌中激活的AKTpS273和p90RSKpT359强烈相关。 这些癌症也差异表达p27 / c-Jun靶基因,这通常提示患者不良预后。 在癌症中,p27的细胞周期抑制作用可通过增加的蛋白水解和降低的蛋白翻译而丧失原有的保护功能。 此次研究揭示了p27之前未知的致癌作用,其中p27可作为c-Jun的共激活因子驱动致癌基因的表达。
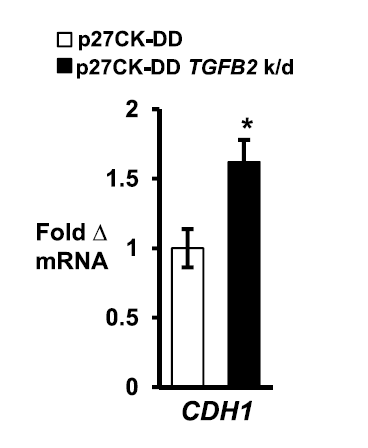
虽然长期以来已知细胞周期蛋白CDK可通过pRb家族的磷酸化和E2F的激活来控制转录,但此次工作明确了p27可作为c-Jun的转录共调节因子促进肿瘤的生成与发展。在超过60%的人类癌症中,PI3K / AKT组成型激活效应子AKT,SGK1和p90RSK1都使p27发生磷酸化。 AKT的活化与细胞质p27的磷酸化和原发性人乳腺癌中C末端p27磷酸化密切相关。在研究者的细胞系模型中由p27差异调节的基因也在原发性乳腺癌中差异表达,高p27pT157表达证实了这种p27作用机制的生物学相关性。此外,这种p27调节的基因谱与较差的癌症存活率密切相关,表明其与疾病进展有关。总之C末端磷酸化可促进p27与c-Jun的相互作用,导致p27 / c-Jun再募集,驱动EMT的发生,最终导致癌症的进展。
参考文献:
Andy Minn, Joyce M. Slingerland. p27 transcriptionally coregulates cJun to drive programs of tumor progression(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发