《Nature》子刊:癌症疫苗遍地开花,个体化疫苗再获突破!
| 导读 | 时至今日,疫苗仍是人类面对疾病的最佳防卫武器。回顾历史,正是依靠疫苗,人类才得以终结肆虐的天花、脊椎灰质炎等高发疾病。嵌合抗原受体T淋巴细胞(CAR-T)和免疫核查点信号阻断抗体PD-1/PD-L1的创新和临床应用更是证明了癌症疫苗的里程碑性地位。 |
时至今日,疫苗仍是人类面对疾病的最佳防卫武器。回顾历史,正是依靠疫苗,人类才得以终结肆虐的天花、脊椎灰质炎等高发疾病。嵌合抗原受体T淋巴细胞(CAR-T)和免疫核查点信号阻断抗体PD-1/PD-L1的创新和临床应用更是证明了癌症疫苗的里程碑性地位。
治疗性癌症疫苗领域经过百年的积淀,最近也获得了重要进展。个体化癌症疫苗的开发和应用,成为癌症免疫治疗的又一条新途径。

近日,苏黎世联邦理工学院的科学家们开发了一种方法,使他们能够确定哪些分子适合于患者的特异性免疫疫苗,从而达到个体化癌症疫苗治疗的效果。 该文章以“Deciphering CD4+ T cell specificity using novel MHC–TCR chimeric receptors, ”为题在线发表在顶级核心期刊《Nature immunology》杂志上。
免疫治疗通过激活免疫T细胞的功能,特异性识别并消灭肿瘤细胞,是人类未来攻克癌症的最有潜力的手段之一。免疫T细胞表面受体(T-cell Receptor, TCR)在识别并清除肿瘤细胞的过程中发挥着关键作用。但是,如何让T细胞更好应用于癌症治疗一直是各国科学家面临的重点和难点,而其中最核心的问题之一是TCR如何鉴定免疫原性肿瘤T细胞。
目前识别 T 细胞的方法遵循两个主要策略。第一个是基于检测 PMHC-TCR相互作用, 通过染色T细胞重组主要组织相容性-(MHC) 四聚体或选择噬菌体颗粒, 酵母或昆虫细胞显示肽–MHC 复合物与重组 TCRs4–6、10。这些方法受到重组试剂与配体的结合亲和力的严重限制, 这种亲和力可能会有很大差异。第二种策略是测量T细胞激活与抗原表达细胞 (Apc) 显示肽池或位置扫描组合肽库的共培养中的 T 细胞激活。这些繁琐的方法定义了导致 T 细胞激活的肽。然而, 许多 T 细胞不与这样的肽池反应。此外, 这些共同的基于肽的方法的预测能力是可变的, 因为随机肽序列一直以来饱受质疑, 并确定的肽图案往往是模糊的,抑或不对应于天然肽。最后, 由于 MHC ii 类所呈现的肽的多样性比 MHC i 类的多数倍级高, 因此为 CD4+ T 细胞寻找特定肽是非常困难的。为了解决这些问题, 我们设计了一种方法, 在筛选工程的标记细胞, 表达携带 CNA 衍生肽的新型PMHC-TCR(MCR) 混合分子库的基础上, 发现 CDNA-分离T细胞所识别的表位。这种方法克服了目前使用的方法的限制, 提供了大量的 Apc, 每个Apc提供一个独特的肽。
因为T细胞是特殊的,总是只识别一种特定的肽,就像钥匙只能识别一个锁一样,这种类型疫苗的另一个先决条件是病人有能够识别这些癌症肽的T细胞。因此,在医生对癌症患者进行免疫之前,必须进行实验室检测,以寻找相应的T细胞和肽对。一个被T细胞识别的肽可以用来进行个性化免疫。
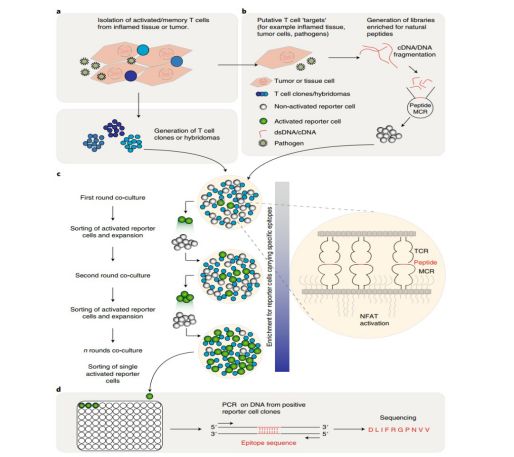
ETH研究人员收集了几百万个标记细胞来进行试验,每个细胞表面都有肿瘤中发现的许多肽中的一个。标记细胞与T细胞相互作用就会变绿,因为它识别了这个肽。这使得科学家们能够识别癌症患者的T细胞所识别的那些肿瘤多肽。
他们首先在小鼠乳腺癌模型中,进行了试验,结果显示他们的方法是有效的。在免疫小鼠中,免疫系统确实会攻击肿瘤;而在科学家用来作为对照的非免疫小鼠中,这种情况却并没有发生。
从根本上说,该技术和个性化免疫技术为所有癌症的治疗带来了希望——特别是与检查点抑制剂相结合,不仅如此,该技术也可以用于研究和治疗自身免疫性疾病,如多发性硬化症或1型糖尿病。
研究结果不仅为T细胞精确识别不同免疫原性抗原提供了重要的理论依据,同时对新生抗原的精确预测、新兴免疫治疗药物的开发以及优化疾病临床免疫治疗方案提供了关键的基础理论和技术支持。
未来如何能够通过这一规律,找到特异性识别肿瘤的T细胞并加以扩增,使其能够更有效的杀伤肿瘤细胞,是未来肿瘤免疫治疗(特别是实体瘤)的临床研究的重要方向之一。
参考文献:
Jan Kisielow, Franz-Josef Obermair & Manfred Kopf Deciphering CD4+ T cell specificity using novel MHC–TCR chimeric receptors(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发