Science子刊 | 鳗鱼中提取的这种物质可治疗脑细胞胶质瘤
| 导读 | 2004年,Pancer等人发现了除Ig外的第二个适应性免疫系统,在《Nature》杂志上首次报道无颌脊椎动物(七鳃鳗和盲鳗)体内有一种新型受体--可变淋巴细胞受体(VLR)。 |
近日,由威斯康星大学麦迪逊分校和德克萨斯大学奥斯汀分校的一组科学家进行的研究发现,VLR作为一个“特洛伊木马”发挥了重要作用:帮助药物通过血脑屏障(blood-brain barrier,BBB)以进入老鼠的大脑,大大延长了脑胶质瘤小鼠的生存率。相关文章以“Identification of variable lymphocyte receptors that can target therapeutics to pathologically exposed brain extracellular matrix”为题在线发表在《Science Advances》杂志上。
VLR能够突破因哺乳动物免疫耐受而不能产生Ig的限制,可以识别更广泛的抗原表位。目前基于Ig的重组抗体药物大多被专利保护,而VLR是一种新型分子,关于该领域的应用开发仍是一片空白。可变淋巴细胞受体(VLR)在识别并特异性结合抗原方面比抗体具有更强的特异性及灵敏度,具有甚至更优于抗体分子的功效。因此,科学家对VLR功能研究的愈来愈深入。有趣的是,VLR可靶向细胞外基质(ECM)。细胞外基质是一种大分子网络,为它们所包围的细胞提供结构。
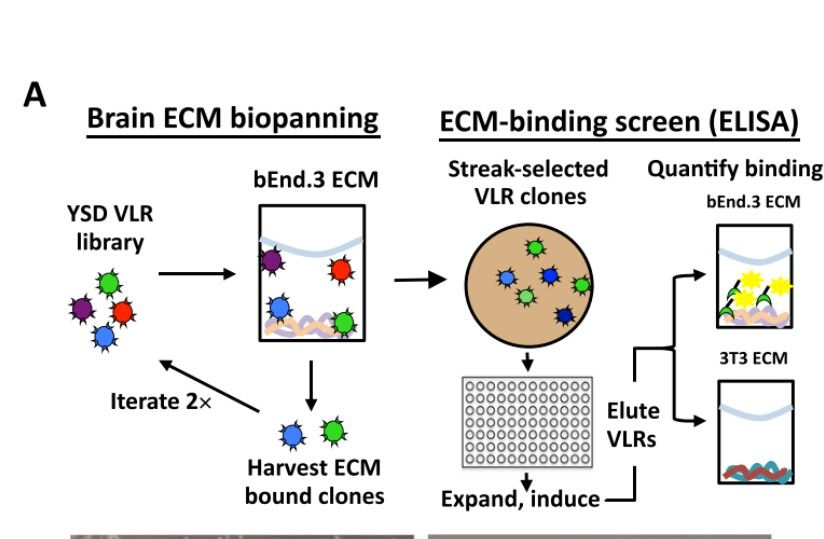
VLR靶向ECM过程
我们知道,健全的血脑屏障对于人体而言是必须的,它能决定哪些细胞和分子能够进入大脑,从而保护这一重要的器官。然而,这层保护伞却会被癌细胞所利用。这些癌细胞仗着有血脑屏障的保护,肆无忌惮地在大脑里生长。免疫细胞和药物等却容易被屏障拒之门外,无法进攻大脑肿瘤。虽然BBB破坏的时间过程、程度和位置具有多变性,然而共同结果却是正常隔离的脑细胞外基质(ECM)的病理性破坏。 因此,靶向具有病理性破坏的BBB的大脑区域可作为向先前“难以接近的”CNS疾病部位递送治疗药物的潜在方法。 该策略可能优于针对细胞内在靶标的治疗,因为正常脑ECM充当靶向配体在治疗后经常导致相关标志物的改变或丢失,从而导致治疗抗性。
为了测试ECM靶向药物递送的潜在益处,研究者首先将该概念应用于无法治愈的胶质母细胞瘤(GBM)。尽管进行了积极的手术,化疗和放射治疗,患者的预后仍然较差,中位生存期不到2年。因此迫切需要更好的GBM治疗。 最近的研究表明GBM靶向免疫治疗通过白细胞介素-13(IL-13)靶向的嵌合抗原受体(CAR)T细胞在选定的患者中可以在短时间内产生显着效果,并且证实了靶向硫酸软骨素蛋白多糖4的CAR T细胞在小鼠模型中的功校。 因此,这针对GBM,特别是ECM组件可以提供新的治疗策略。
假设GBM中病理暴露的脑ECM可以作为治疗目标,该研究小组使用胶质母细胞瘤的小鼠模型,用与多柔比星结合的VLR作为治疗药,(VLR从Lampreyr中提取。Lampreys是最古老的鳗鱼类无颌鱼之一。 它们遍布世界各地温带地区的河流和沿海海域)。结果发现,该治疗下的实验组小鼠相较于对照组小鼠明显延长了生存期。在全身给药后,P1C10(靶向脑ECM的靶向VLR候选物)特异性地在具有甘露醇破坏的BBB的脑中和在两种不同的颅内成胶质细胞瘤模型中的破坏的BBB区域累积。 该研究证明,VLR可用于选择性地靶向病理暴露的脑ECM并递送药物有效负载。
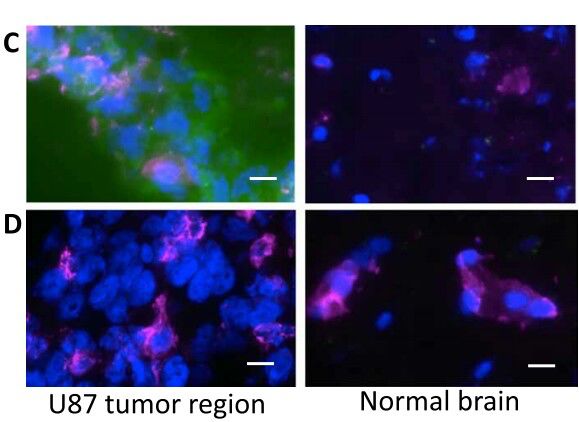
VLR与多柔比星联合作用于血脑屏障
展望未来,研究人员希望尝试将VLR与其他类型的抗癌药物(包括免疫疗法中使用的那些药物)结合起来,以了解这些分子如何与多种多样的治疗方法协同工作。
参考文献
Benjamin J. Umlauf, Paul A. Clark, Identification of variable lymphocyte receptors that can target therapeutics to pathologically exposed brain extracellular matrix

为了回馈转化医学网忠实用户,现在起报名参加第二届上海国际癌症大会,前50名可享受半价优惠。识别这个二维码就可以报名了!

近年来,随着肿瘤基础与临床研究领域新技术新方法不断革新,癌症研究和临床诊断治疗取得了重大进展。为了进一步推动癌症诊治技术、方法创新,促进基础研究向临床和产业转化,延续首届会议“传承,创新,卓越,引领”的主题,第二届上海国际癌症大会将于2019年10月11-13日在上海召开。我们诚挚地邀请您参加本次大会,共同努力打造高端的学术交流平台,为海内外同道们搭建肿瘤基础、临床与转化协作和友谊的桥梁。期待10月,我们上海见!
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发