《PNAS》:改良CRISPR再显神威!成功靶向三阴性乳腺癌,有效率高达77%!
| 导读 | 乳腺癌的治疗已步入分类而治的时代,部分亚型已找到了有效的治疗靶点。 |

乳腺癌的治疗已步入分类而治的时代,部分亚型已找到了有效的治疗靶点。例如,腔面型乳腺癌的抗雌激素内分泌治疗,HER2阳性乳腺癌的抗HER2靶向治疗,而三阴性乳腺癌(TNBC)(ER-、PR-、HER2-)作为其中“高段位”选手,仍然缺乏明确的治疗靶点,三阴性乳腺癌的治疗依旧是世界性的医学难题。
近年来,科研人员一直致力于三阴性乳腺癌的靶向治疗,满路荆棘却从未放弃,近日科学家们终于在基因编辑领域看到了治疗三阴性乳腺癌的新曙光,利用靶向性CRISPR基因编辑系统可成功阻止TNBC肿瘤在体内的生长,安全无害,为三阴性乳腺癌的治疗开辟了新格局。

提及乳腺癌基因,首当其冲的自然是明星基因HER2及BRCA1/2了,殊不知,在三阴性乳腺癌中,一种名为Lipocalin2的基因才是真正的王者,小分子脂质运载蛋白Lipocalin-2(LCN2),作为HIC1(三阴性乳腺癌的肿瘤抑制因子)直接调控的下游靶基因,在介导乳腺癌的侵袭转移过程中发挥了重要作用。
在乳腺癌术前患者血清中,LNC2在三阴性乳腺癌中呈现出了高分泌状态。如此看来,分泌型小分子蛋白LCN2可能是通过NGALR受体活化了下游AKT信号通路,从而促进了乳腺癌的侵袭转移。而HIC1-LCN2轴可作为一个特异性的分子亚型预后标志物,为三阴乳腺癌治疗提供了一个有吸引力的候选目标。
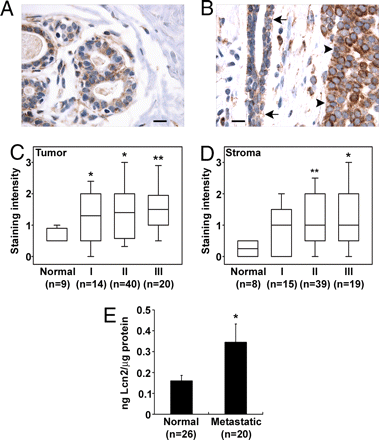
LCN2促进乳腺癌细胞生长
靶点有了,如何delete掉呢?研究人员想到了CRISPR系统,不可否认,自问世以来,CRISPR的成功是一发不可收拾的,距开始利用CRISPR/Cas进行基因编辑不到一年时间里,人们就实现了用该系统来校正遗传疾病,从基础生物学研究领域到植物育种、新药研发等应用领域,已有广泛的应用。然而,由于缺乏有效的CRISPR传递系统,其在癌症治疗领域,一直表现平平。
通过不断地探索,人们发现了两种提高CRISRP递送效率的方法:一种以病毒为载体来传递,而该方法因载体容量及显著的毒副作用而受到限制,另一种便是将CRISPR系统封装在阳离子聚合物或脂质纳米粒中来进行递送。在本次研究中,波士顿儿童医院的研究人员选择了后者并加以改善,将CRISPR编辑系统封装在由无毒脂肪分子和水凝胶组成的软“纳米凝胶”中,将抗体附着在凝胶表面,通过识别和定位ICAM-1(三阴乳腺癌的药物靶点),来引导CRISPR纳米粒子抵达肿瘤细胞所处位置。
软“纳米凝胶”更有攻击力及穿透性,当较硬的纳米粒子被机体正常细胞捕获时,软粒子便与肿瘤细胞膜融合,直接在细胞内传送CRISPR有效载荷。而一旦进入细胞内,CRISPR系统就会破坏并敲除Lipocalin2。
在本次研究中,改良版CRISPR基因编辑系统的递送成功率高达81%,进一步在小鼠模型中进行实验,则成功阻止了77%三阴性乳腺癌小鼠的肿瘤细胞生长。
实验表明,癌基因的丢失抑制了肿瘤细胞的侵袭性行为,不仅如此,被注入由软纳米凝胶包裹的CRISPR编辑系统的三阴性乳腺癌小鼠未表现出明显的不适,进一步印证了改良版的安全无害作用,推动了药物研发进程!
这项研究打破了三阴性乳腺癌靶向治疗僵局,为三阴性乳腺癌的治疗提供了理论基础。未来研究中研究人员还将继续深入动物实验研究,以尽快将改良CRISPR系统推进临床。(转化医学网360zhyx.com)
参考文献
Peng Guo, Jiang Yang, Jing Huang, Therapeutic genome editing of triple-negative breast tumors using a noncationic and deformable nanolipogel.
热点研究
肿瘤研究
《转》访嘉宾
 腾讯登录
腾讯登录



还没有人评论,赶快抢个沙发