Nature详谈:熬夜肠胃难受原来是因为它!
| 导读 | 经常熬夜或出差的人,更容易发胖甚至超重,并且大多伴有肠道炎症等症状。但造成这一现象的生理机制尚不清楚 |
导 读:经常熬夜或出差的人,更容易发胖甚至超重,并且大多伴有肠道炎症等症状。但造成这一现象的生理机制尚不清楚。
近日,来自葡萄牙的查帕利莫德未知中心(Champalimaud Centre for the Unknown)的研究人员在《Nature》上发表了最新研究,他们发现:3型天然淋巴细胞(ILC3s)的功能可以直接由大脑昼夜节律钟控制,而这组免疫细胞又和肠道健康息息相关。

2017年的诺贝尔生理学或医学奖,为我们揭开了“生物节律钟”的神秘面纱,也使其概念逐渐科学化,并且成为了人们日益关注的健康热点。实际上,包括人类在内的许多有机生命体,都有自己的内部时钟,这种时钟能够帮助我们预料并且适应每天的节律,这便是“生物节律钟”,又称为“生物钟”。
在保证精准性的前提下,生物钟还能调节一些关键的机体功能,如激素水平、代谢机制、睡眠和体温等。而当外部环境和内部生物钟之间发生短暂的不匹配时,机体稳态会受到一定影响。例如:熬夜或长期跨时区飞行出现的时差反应等,这些都会破坏机体生物钟,进而影响代谢和生理功能。
研究证明,当人们睡眠不足,或者睡眠习惯改变时,可能会对健康造成严重不良影响,导致免疫功能性疾病,比如免疫力下降,肠道炎症等。
为了解释这一现象的分子机制,Henrique Veiga-Fernandes研究团队将免疫反应与生物昼夜节律钟的活动联系起来,对免疫细胞和生物钟间的相互作用机制和关联性进行了探究。
研究人员发现,在肠道中存在的各种免疫细胞中,3型天然淋巴细胞(ILC3s)最容易受到个体生物钟基因的干扰。
ILC3s是机体内炎症反应、微生物群落组成以及新陈代谢途径的主要调控因子。并且,它和神经元细胞能够在不同的粘膜部位相互作用,来引导粘膜防御。
利用小鼠模型,研究发现当打乱小鼠的生物钟时,其肠道中ILC3的细胞数量显著减少,进而破坏肠道屏障,造成严重的炎症反应,并增加脂肪的积累。
那昼夜节律的改变是如何影响肠道中ILC3的稳态呢?
研究人员找到了一种“标签”蛋白(Arntl),这种蛋白质如同“分子拉链”,负责指示肠道内的临时居民ILC3s迁移到指定位置——如果ILC3想要到达肠道上皮,它必须在细胞膜上分泌表达Arntl蛋白才能准确到达目的位置。然而,当大脑中昼夜节律钟无法正常运行时,ILC3s将无法表达这种标签蛋白,这也意味着它们无法到达预定目的地。
研究还发现昼夜节律调节因子Arntl蛋白还可以引起ILC3的自主消融,进而导致肠道中ILC3稳态紊乱、上皮反应性受损、微生物种群失调、肠道易感染和脂质代谢混乱等。
此外,光暗周期、进食规律和微生物信号都影响ILC3时钟基因的表达,并且影响程度不同,其中光信号是主要影响因素。
该研究进一步揭示了一个昼夜节律的神经-免疫回路,即通过外环境光照控制小鼠的肠道ILC3稳态,从而影响肠道防御和脂质代谢等生理反应。
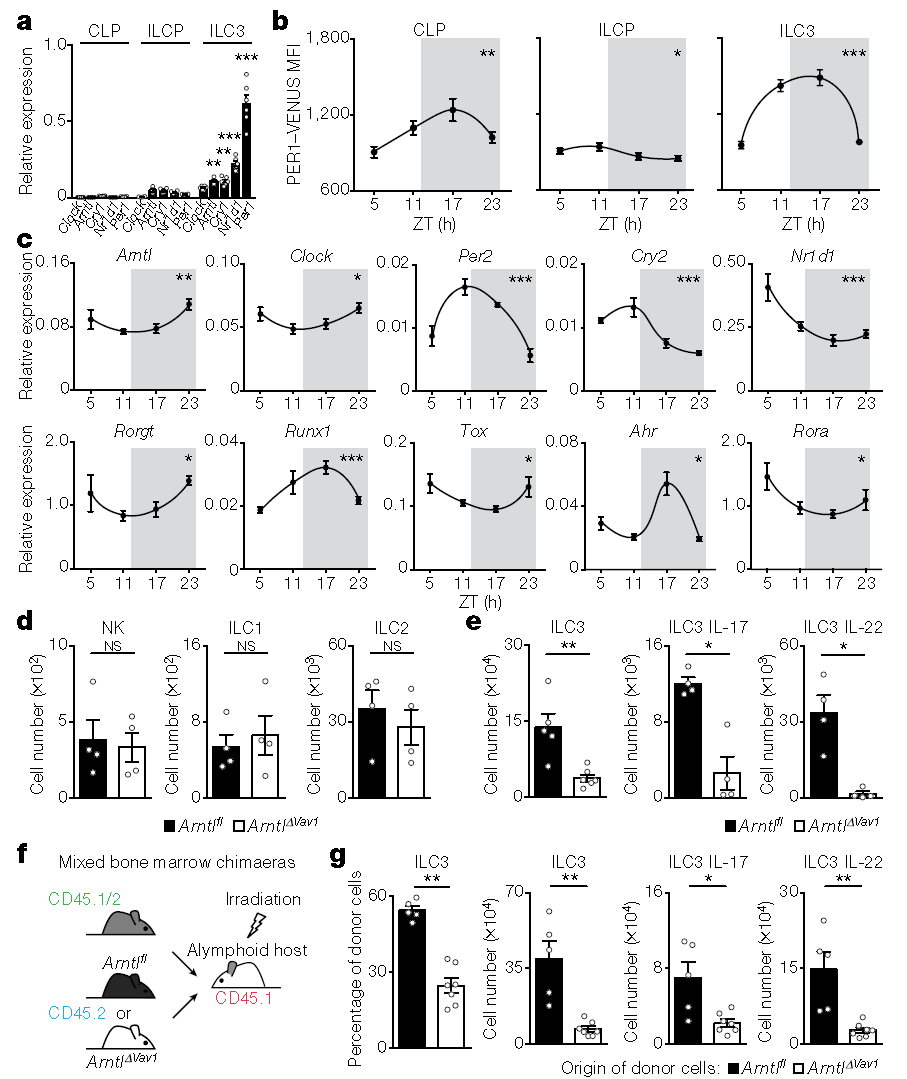
肠道ILC3中时钟基因的表达受昼夜节律控制
这一发现为人类进一步了解肠道健康和机体稳态提供了新的见解和理论依据。打开了人们对生物钟和肠道健康相互作用的新视野——神经系统可以调节免疫系统功能。大脑控制的生物节律“大时钟”负责接收外界光源信号,进而同步给身体中细胞里的“小时钟”,使所有系统同步运行,正是身体中神经-免疫回路的完整才保证了机体的稳态。
所以,当你长时间熬夜加班,缺乏足够睡眠时,你的生物钟正在被打破,而你的肠道也正在“备受煎熬”。早睡早起,规律作息,才能健康生活!
参考文献:
Light-entrained and brain-tuned circadian circuits regulate ILC3 and gut homeostasis, Nature (2019). DOI: 10.1038/s41586-019-1579-3 , https://nature.com/articles/s41586-019-1579-3

(转化医学网360zhyx.com)
 腾讯登录
腾讯登录



还没有人评论,赶快抢个沙发