结直肠癌新突破—解析KRAS基因突变的两副面孔
| 导读 | 目前治疗结直肠癌的一线靶向药物主要是西妥昔单抗(爱必妥),但它对KRAS基因突变的结直肠肿瘤细胞的抑制效果存在差异,具体机制还不清楚。 |
结直肠癌的早期诊断率低,被发现时多已为中晚期,只能依靠化疗。相较于传统药物的明显缺陷,分子靶向治疗逐渐成为了晚期肿瘤综合治疗的研究热点。
目前治疗结直肠癌的一线靶向药物主要是西妥昔单抗(爱必妥),但它对KRAS基因突变的结直肠肿瘤细胞的抑制效果存在差异,具体机制还不清楚。
针对这一现状,索尔克生物研究所的研究人员联合计算生物与实验研究,首次解析了KRAS基因突变在西妥昔单抗靶向药抗肿瘤中的作用机制。

结直肠癌新杀手——西妥昔单抗靶向药
结直肠癌是我国最常见的消化道恶性肿瘤之一,发病率高,致死率高。据报道,2018年我国结直肠癌的发病率和致死率,在男女性中均高居前五。由于结直肠癌患者发现时多为中晚期,因此化疗是主要治疗手段。
随着精准治疗研究的深入,人们发现包括结直肠癌在内的多种肿瘤发生都和表皮生长因子受体(EFGR)的过表达密切相关,因此EGFR的单克隆抗体——西妥昔单抗应运而生,因疗效显著,已成为目前临床上使用最为广泛的靶向药物之一。
肿瘤耐药王者——KRAS基因突变
虽然西妥昔单抗对大多数结直肠癌有明显效果,但是约40%的患者却无法从中受益。因为这部分患者携带的KRAS致癌基因发生了突变,导致它所编码的K-RAS蛋白持续活化,因此即使阻断了上游的EGFR过表达,也无法调控下游事件的发生,肿瘤仍会不断生长和增殖。
那是否所有的KRAS基因突变都会导致西妥昔单抗给药失效呢?
其实不然。有研究发现,即使都属于KRAS基因突变,但携带KRAS G13D突变的患者使用西妥昔单抗却是有效的。这一研究似乎与之前的结果相互矛盾,也让KRAS基因突变对西妥昔单抗的抗肿瘤疗效的影响又添新谜团。
近距离围观KRAS致癌基因和西妥昔单抗药的“相爱相杀”
那么,KRAS基因突变到底和西妥昔单抗给药抗肿瘤之间如何作用反应的呢?
近日,索尔克生物研究所的研究团队通过计算生物和实验验证,破解了这一谜团。
研究人员首先利用计算模型模拟了KRAS突变前和突变后细胞中复杂的生化反应,根据对每个过程的反应解读和之前的临床试验数据,梳理出了健康KRAS基因和突变KRAS基因之间可能存在的生物学差异,从而更准确地量化KRAS G13D患者独特的反耐药机制。通过计算生物学的分析,可以推断出几种可能存在的作用机制。
随后,研究人员通过三种不同的细胞系逐一验证了计算模型的推断假设。结果发现,在KRAS没有突变的细胞中,作为肿瘤抑制因子的神经纤维蛋白NF1可以保证KRAS蛋白正常表达。而大多数KRAS发生突变后,会异常活跃,神经纤维蛋白识别后,无法控制KRAS蛋白,表达异常;而当KRAS G13D基因突变后,开始异常活跃时,NF1蛋白则识别不出异常,仍然保持和控制健康的KRAS蛋白表达。
这一发现证明,与NF1相互作用强且竞争性抑制NF1的KRAS突变体,能以与EGFR无关的方式驱动野生型RAS活化,而KRAS G13D与NF1蛋白相互作用弱且不能竞争性抑制NF1,因此KRAS G13D突变后的细胞使野生型RAS活化的同时,仍然可以依赖EGFR发挥作用。
因此,只要有神经纤维蛋白NF1可以抑制KRAS的异常活跃,西妥昔单抗靶向药就能够有效抑制肿瘤。
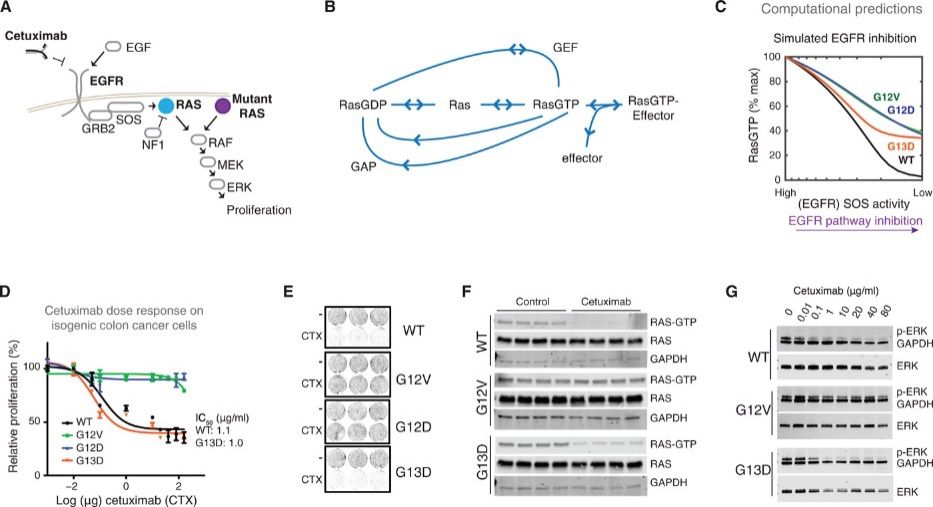
结直肠肿瘤中KRAS突变体对抗EGFR药物西妥昔单抗的敏感性反应
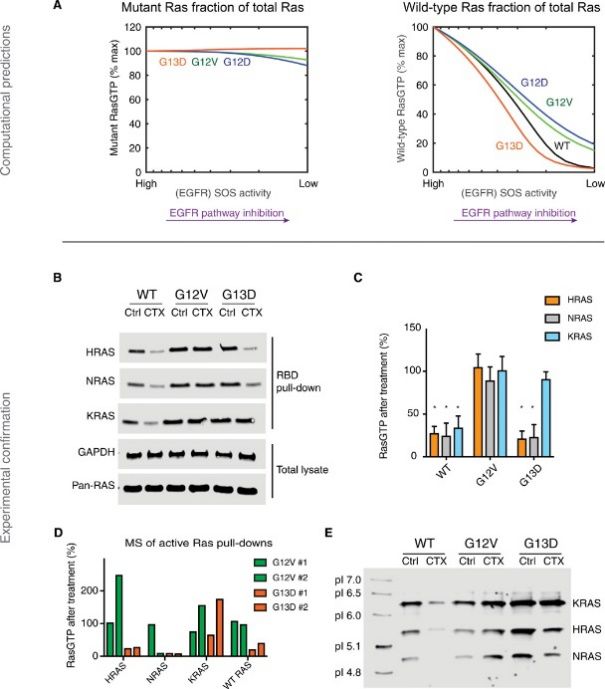
RAS模型预测和实验验证:野生型RAS活化可以识别敏感性和非敏感性癌细胞
这项研究具有直接的临床意义,不仅解析了携带KRAS G13D突变的肿瘤对西妥昔单抗独特的反耐药机制,也使KRAS基因突变检测不再一刀切,让更多结直肠癌患者可以从靶向药西妥昔单抗受益,更让临床医生能够放心地给药治疗。
这一发现也证明了计算系统生物学和实验生物学联合解决肿瘤个性化治疗问题的真正实力,强调了建立基于基础生物化学的数学模型和模拟算法的重要意义。(转化医学网360zhyx.com)
参考文献:
Thomas McFallA, et al. Systems mechanism for KRAS mutant allele–specific responses to targeted therapy. Science Signaling, 24 Sep 2019: Vol. 12, Issue 600, eaaw8288
DOI: 10.1126/scisignal.aaw8288

 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发