Science子刊背靠背:阿尔茨海默症浮现新的诊断指标!
| 导读 | 血脑屏障介导血管和大脑之间的信息交互,而衰老和神经系统疾病发生通常与血脑屏障损伤相关 |

作者:Walter
导 语: 血脑屏障介导血管和大脑之间的信息交互,而衰老和神经系统疾病发生通常与血脑屏障损伤相关。动物实验表明血脑屏障损伤导致星型胶质细胞功能障碍、神经炎症、胞外基质组成变化、兴奋性突触增生,降低癫痫发作阈值,加速神经退行的产生。
近日,来自加州大学伯克利的Daniela Kaufer以色列班固利恩大学的Alon Friedman课题组发现,阿尔兹海默症(AD)患者的大脑皮层存在异常阵发性低频放电(Paroxysmal slow cortical activity,PSWE)。PSWE在衰老、癫痫和AD模型鼠脑电中均存在,发生概率与血脑屏障损伤和疾病进程成正相关,提示脑电中PSWE成分可能成为AD新的临床诊断指标,血脑屏障的病理转变可能成为神经系统疾病的潜在机制以及治疗靶标。

随着世界人口老龄化,阿尔兹海默症(AD)的发病率逐年上升。据估计,2050年,世界范围内将有八千万人口罹患AD。阐释AD的发病机制对其早期诊断和治疗具有重要意义。最新研究提示,血脑屏障的微血管病变可能是导致AD和神经退行的主要因素。
事实上,AD病人中多数存在未被确诊的癫痫并发。癫痫发生的重要病理诱因之一是脑微血管的血清白蛋白渗透,在神经毡中蓄积导致的血脑屏障损伤(brain barrier disfunction, BBBd),进一步造成星型胶质细胞功能障碍、神经炎症、胞外基质组成变化、兴奋性突触增生,从而降低癫痫发作阈值,加速神经退行的产生。
证据表明,在AD和其他类型的痴呆症中均能观察到异常的特征化慢波放电。结合“two-hit” 血管假说的提示,作者猜想BBBd会引起癫痫样神经网络重构,造成进一步神经功能障碍和变性。因此,Daniela Kaufer和Alon Friedman等在AD、癫痫的病人和动物模型中验证异常阵发性慢波放电的存在,说明其发生的脑区位置和病程依赖性,证明PSWE是血脑屏障损伤与AD发生之间的重要联系。
首先,研究者通过脑电记录探究AD患者、轻度认知障碍患者以及同年龄对照组中大脑功能变化。研究团队通过频谱分析,发现AD患者α节律能量显著降低,θ节律能量显著增加,并观察到异常阵发性慢波放电,将皮层脑电从正常活动瞬时切换短暂低频放电,切换后持续时间大于5秒,频率低于6 Hz的事件定义为(Paroxysmal slow cortical activity,PSWE)。AD患者中每分钟PSWEs的发生率显著高于对照组,且发生概率与病人的精神状态检查得分成负相关。
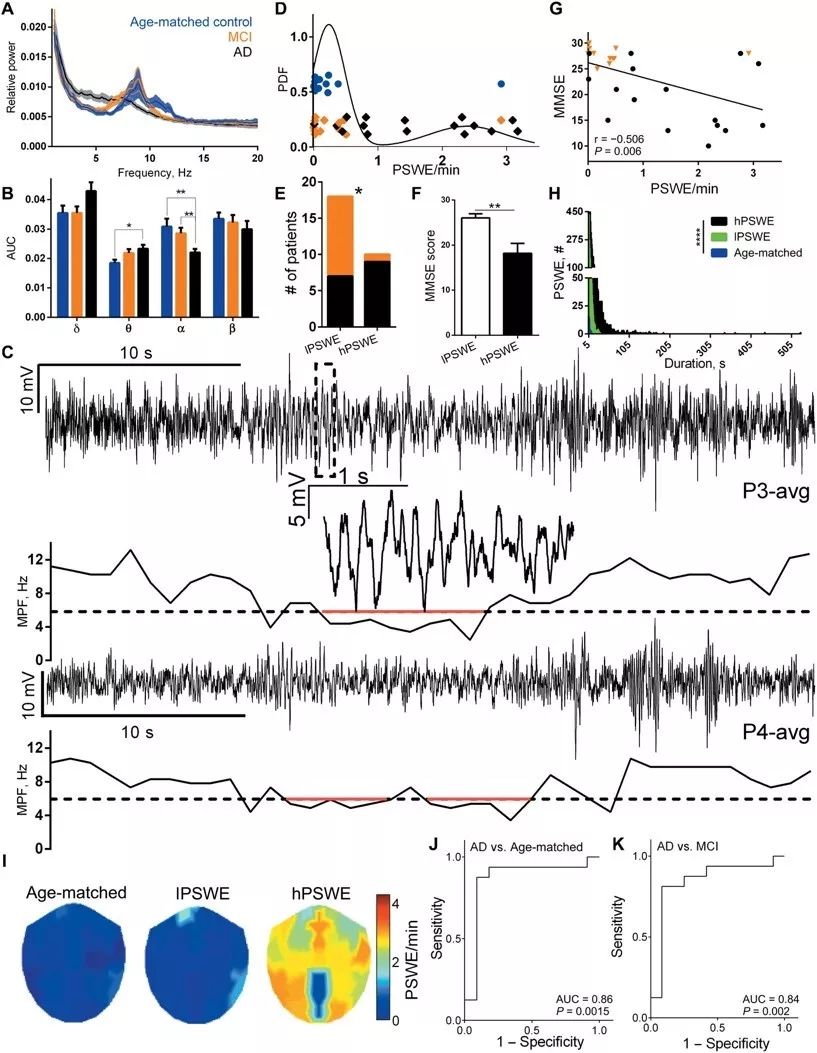
痴呆相关的异常阵发性低频放电
由于抗癫痫药对某些AD病人有效,AD和癫痫的并发受到越来越多的关注,作者进而探究癫痫患者中血脑屏障损伤和PSWEs的发生情况。通过对比增强磁共振成像(DCI-MRI)发现,癫痫患者血脑屏障损伤较对照组显著,脑电中PSWE成分显著增加,并且PSWEs的发生概率与血脑屏障损伤程度具有正相关性。另外,研究者在癫痫持续状态自发模型的小鼠中验证PSWEs存在于发作间期,与癫痫发作脑电具有明显不同的特征。
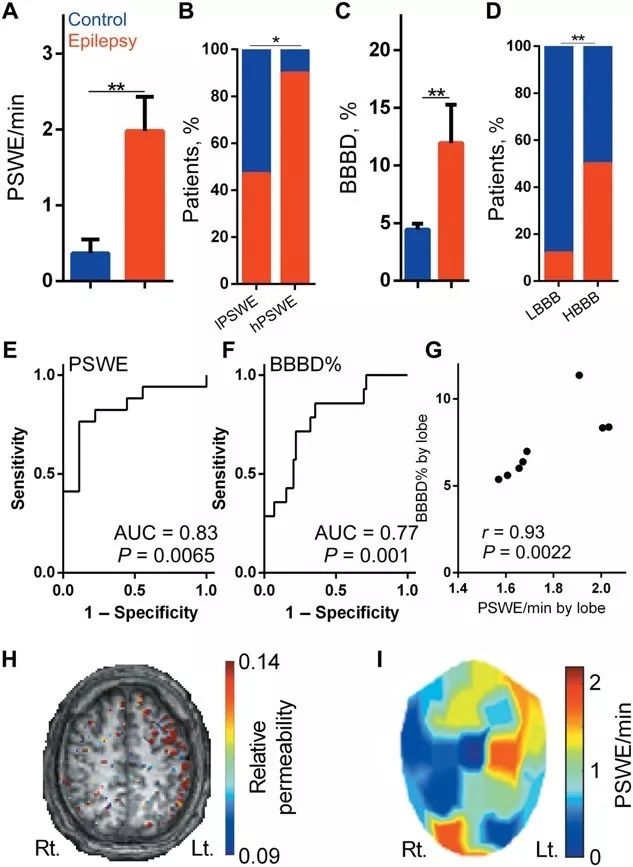
在癫痫患者中PSWEs与血脑屏障共定位
接着,作者对衰老小鼠的脑电PSWEs成分和血脑屏障损伤进行表征。衰老是一种与年龄相关的认知能力下降的自然模型,与年轻小鼠相比,研究者们同样观察到脑电PSWEs成分和血脑屏障损伤增加,在广泛认同的AD模型5xFAD年轻小鼠中也得到类似的结果。
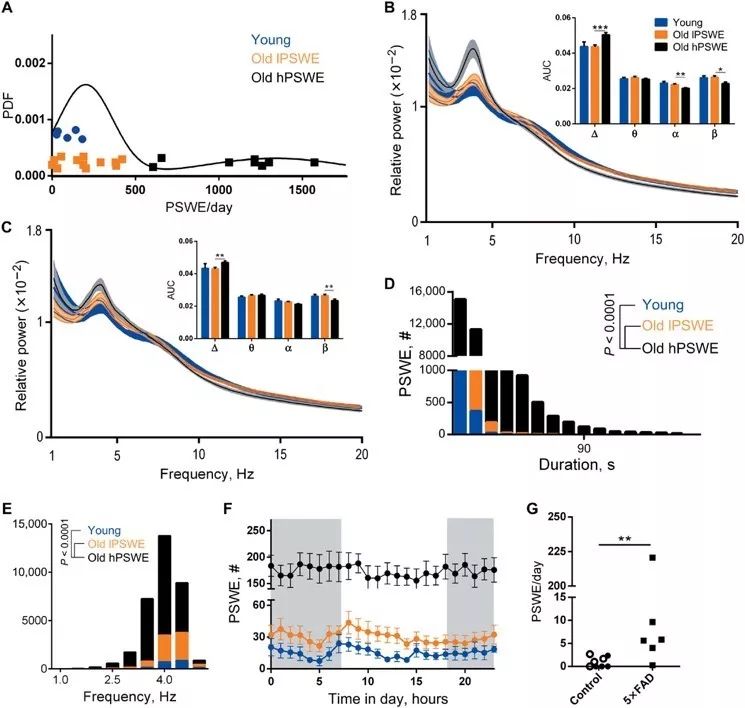
衰老动物脑电中含有PSWE成分
最后,研究者通过连续4周大鼠右侧脑室注射血清白蛋白的方式,造成血脑屏障损伤模型,观察到与AD病人类似的脑电特征,包括δ节律(1至5 Hz)频谱能量显著上升,α和β节律(12至20 Hz)频谱能量显著下降,注射半球皮层脑电中PSWEs发生频率显著增加,PSWEs每次维持时间显著延长,验证白蛋白渗入脑神经毡足以诱发神经功能障碍。
在背靠背发表的文章中,作者证明了IPW阻断TGFβ信号传导可改善老年小鼠的认知功能并减少PSWE的发生,进一步支持BBBd-TGFβ信号传导造成以PSWEs为特征的皮质功能障碍的假设。
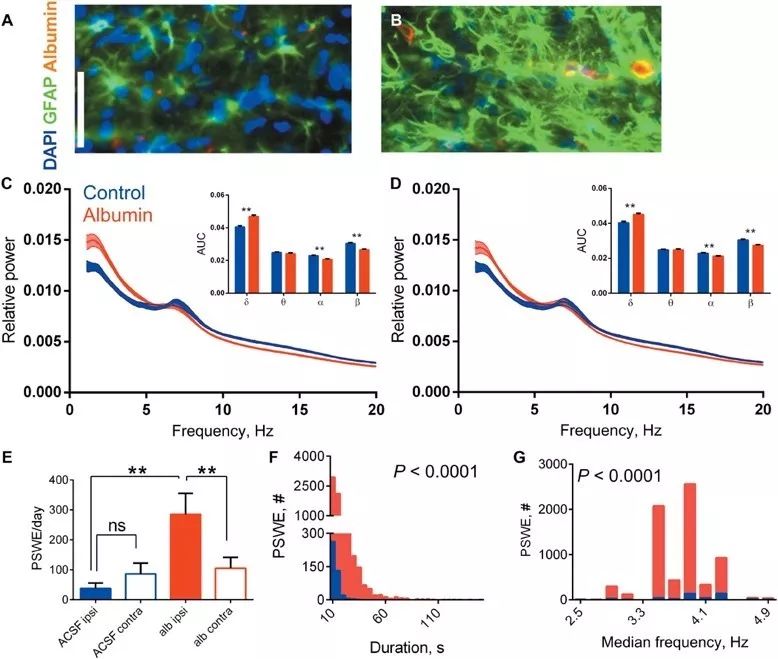
血清白蛋白长时程浸润引起PSWEs
Daniela Kaufer和Alon Friedman等发现脑电中阵发性低频放电(PSWEs)能够用于识别和定量评估皮层的异常神经活动,并且能反映血脑屏障损伤程度。PSWEs可以作为AD和癫痫等脑部疾病的诊断指标,以及针对血脑屏障损伤治疗药物或抗癫痫药的药效学指标。并且,血脑屏障的病理转变可能是神经系统疾病发生的潜在机制以及治疗靶标!(转化医学网360zhyx.com)
参考文献
Dan Z. Milikovsky, et al. Paroxysmal slow cortical activity in Alzheimer’s disease and epilepsy is associated with blood-brain barrier dysfunction. Science Translational Medicine. 04 Dec, 2019.
V. V. Senatorov Jr.,et al. Blood-brain barrier dysfunction in aging induces hyperactivation of TGFβ signaling and chronic yet reversible neural dysfunction. Science Translational Medicine. eaaw8954, 2019.
Berislav V. Zlokovic. Neurovascular pathways to neurodegeneration in Alzheimer’s disease and other disorders. Nature Review Neuroscience. 28 May, 2014
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发