Nature子刊:为CAR-T装备“盔甲”,消灭实体瘤不是梦!
| 导读 | 2017年,美国FDA批准了诺华和凯特的两款靶向CD19的CAR-T细胞疗法,给许多白血病和淋巴瘤患者带来了希望。然而,对于实体瘤,CAR-T一直没有突破。12月5日,诺华宣告暂时放弃CAR-T治疗实体瘤的技术开发,侧面反映了其困难重重。 |
2017年,美国FDA批准了诺华和凯特的两款靶向CD19的CAR-T细胞疗法,给许多白血病和淋巴瘤患者带来了希望。然而,对于实体瘤,CAR-T一直没有突破。12月5日,诺华宣告暂时放弃CAR-T治疗实体瘤的技术开发,侧面反映了其困难重重。
 血液瘤约占癌症比例的10%,实体瘤占比90%。“CAR-T之父”Carl H. June曾预测,在5年之内,CAR-T疗法可治愈所有的血液肿瘤。而对于实体瘤,由于缺乏理想靶抗原、肿瘤微环境、异质性等原因,一直没有突破性进展。
血液瘤约占癌症比例的10%,实体瘤占比90%。“CAR-T之父”Carl H. June曾预测,在5年之内,CAR-T疗法可治愈所有的血液肿瘤。而对于实体瘤,由于缺乏理想靶抗原、肿瘤微环境、异质性等原因,一直没有突破性进展。
对于实体瘤,静脉注射CAR-T细胞后,CAR-T细胞很难进入肿瘤组织中,即使是进入肿瘤组织的CAR-T细胞,也因为肿瘤微环境中免疫抑制因子、营养失衡等因素难以增殖并发挥杀伤功能。在该研究中,研究人员将CAR-T细胞包埋于镍钛薄膜中,在小鼠模型中,可消除70%肿瘤,并可使CAR-T细胞扩增232倍。该研究成果为细胞疗法有效对抗实体瘤迈出了重要一步。
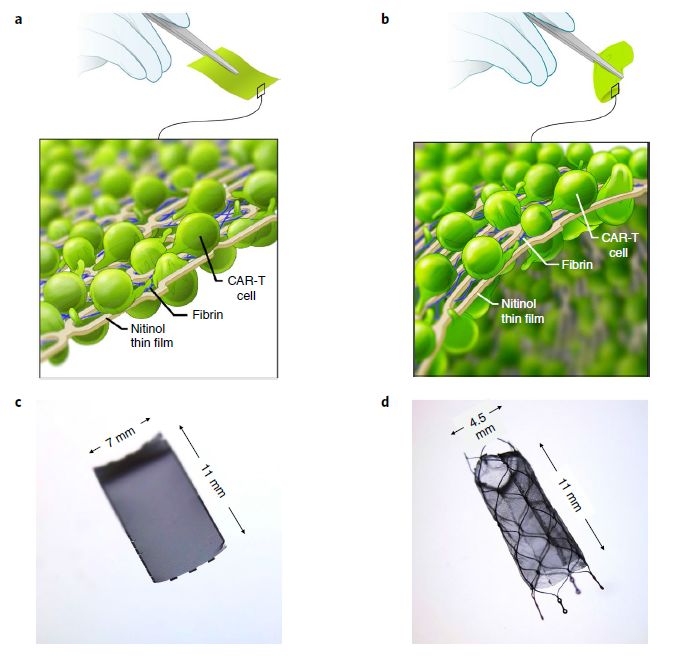
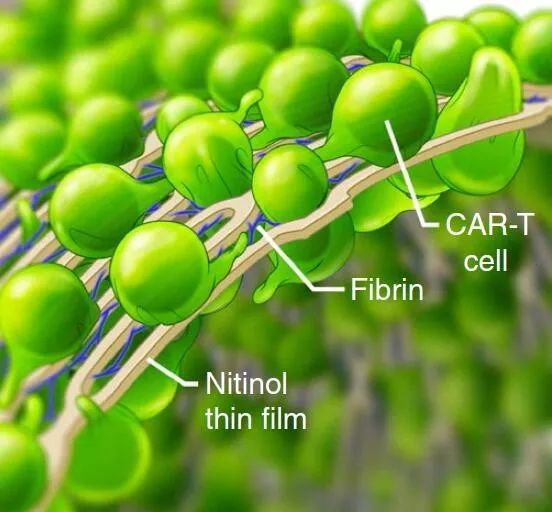
包埋有CAR-T细胞的镍钛合金示意图。左侧为片状薄膜,在该研究中用于实体瘤治疗;右侧为管状支架,在该研究中用于肿瘤支架
该镍钛薄膜厚度为10μm,采用纤维蛋白凝胶进行包被。由于细胞毒性T细胞表达纤维蛋白整合素,CAR-T细胞可快速迁移至纤维蛋白凝胶中。同时,纤维蛋白凝胶中添加有CD3、CD28和CD137抗体,可促进CAR-T细胞的快速扩增。
在小鼠卵巢癌肿瘤模型中,研究人员 将靶向肿瘤抗原ROR1的CAR-T细胞包埋于上述镍钛薄膜中,并植入被卵巢癌细胞侵袭的小鼠隔膜处。在第20天,70%的小鼠肿瘤已经完全消失。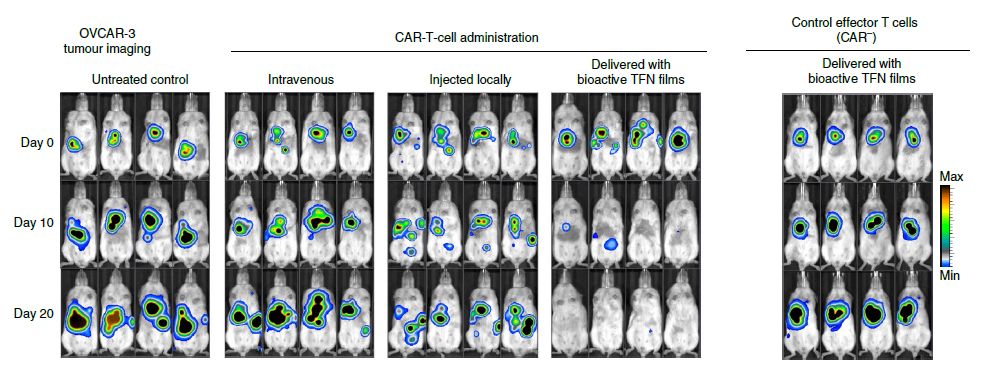
小鼠卵巢癌肿瘤模型的癌细胞生物发光成像。左图为未经T细胞治疗的对照,右图为包埋未经修饰的T细胞的镍钛薄膜对照,中间3组处理方式分别为静脉注射CAR-T细胞、瘤内注射CAR-T细胞、包埋于镍钛薄膜的CAR-T细胞。
而且,对T细胞的生物发光成像表明,包埋于镍钛薄膜中的CAR-T在肿瘤部位出现明显的扩增,是静脉注射的500多倍,是瘤内注射的800多倍。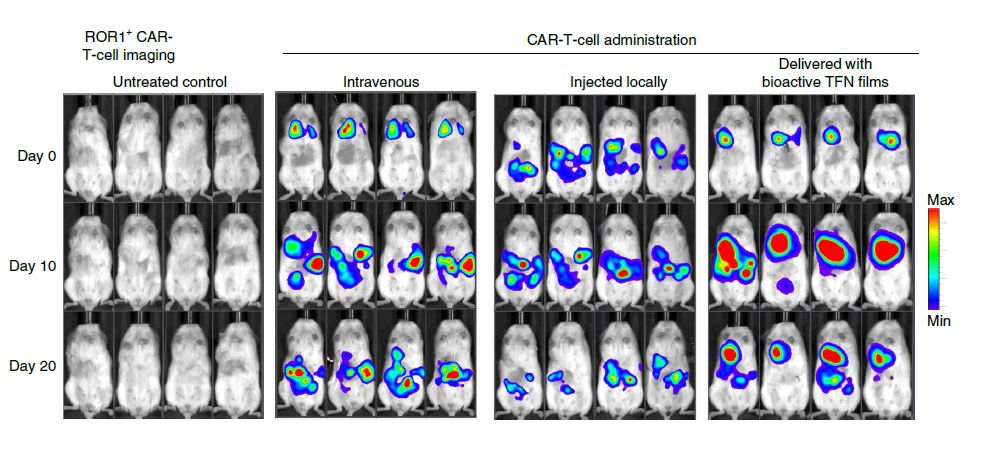
小鼠卵巢癌肿瘤模型的CAR-T细胞生物发光成像。左图为未经T细胞治疗的对照,右侧3组分别为静脉注射CAR-T细胞、瘤内注射CAR-T细胞、包埋于镍钛薄膜的CAR-T细胞
镍钛合金是一种形状记忆合金,具有很好的生物相容性,已应用于骨折后修复、牙齿矫正、动脉支架、肿瘤支架等。利用磁控溅射技术可以制备出复杂的、高结构分辨率的镍钛薄膜。一些晚期癌症会压迫血管、消化道、呼吸道,临床上对于这种恶性梗阻的治疗方法通常的采用镍钛合金支架。然而,在植入体内后,由于肿瘤侵袭,会导致再次阻塞。在该研究中,研究人员发现,用包埋有CAR-T细胞的镍钛管状薄膜可阻止肿瘤生长,避免发生阻塞。因此,这种方法在肿瘤支架中有很好的应用前景。不过,这种方法还需要更多临床试验的验证,以评估其安全性和适用范围。
与传统细胞递送技术相比,这种CAR-T细胞递送方法对于实体瘤的细胞治疗很有优势。由于这种镍钛薄膜具有高度可定制性(比如三维支架),因此可以通过专门的设计来提高肿瘤治疗效果。

可定制的高精度镍钛薄膜
聚合物支架的结构和孔径大小具有一定的随机性,而这种镍钛薄膜的结构和孔径是高精度的,这就为准确预测CAR-T细胞迁移和释放提供了可能,也提高了结果的可重复性。另外,该薄膜厚度仅为10μm,1平方厘米可递送7.9 × 106 个细胞,避免了褐藻酸盐支架、水性凝胶等过厚导致的氧气和营养物质交换问题。而且,添加的CD3、CD28和CD137抗体对CAR-T细胞的效果与相应的抗体磁珠效果类似。总之,该研究设计的这种镍钛薄膜是一个高度灵活的系统,对免疫细胞杀伤肿瘤具有定位和支撑功能。通过对结构、形状、细胞因子等因素的设计,可用于多种实体瘤的细胞治疗。(转化医学网360zhyx.com)
参考文献:Nitinol thin films functionalized with CAR-T cells for the treatment of solid tumours, Nature Biomedical Engineering (2019). DOI: 10.1038/s41551-019-0486-0.
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发