【突破】显著提高外泌体产量和核酸包载效率,基因治疗取得新进展!
| 导读 | 基因疗法具有治疗多种疾病的巨大潜力,但对于带负电核酸大分子的靶向递送一直是基因疗法发展的限速步骤。相较于病毒载体和纳米材料的毒性和免疫原性,自体细胞分泌的外泌体更可能成为临床应用的核酸载体。 |
基因疗法具有治疗多种疾病的巨大潜力,但对于带负电核酸大分子的靶向递送一直是基因疗法发展的限速步骤。相较于病毒载体和纳米材料的毒性和免疫原性,自体细胞分泌的外泌体更可能成为临床应用的核酸载体。
俄亥俄州立大学化学与生物工程学院的James Lee课题组发明了一种细胞纳米化生物芯片,在数量级上提高外泌体生产和核酸包载效率,在靶向性和疗效上大大超越目前临床实验正在测试的外泌体包载的基因治疗药物!这些结果12月16日发表在《Nature Biomedical Engineering》上。

外泌体是细胞内的多囊体分泌到细胞外,半径为40-150 nm的囊泡,在生理状态下介导细胞间通讯。作为基因治疗中的核酸载体,外泌体的生物相容性好,其膜上天然表达跨膜和膜锚定蛋白,因此具有体内长循环以及跨血脑和血肿瘤屏障的优点。Nature曾在2017年报道外泌体的胰腺癌靶向治疗作用。然而,仅有特定种类的细胞能够分泌外泌体,且具有产量稀少、核酸包载量低、靶向修饰难度大等缺点。
因此,研究者们发明了一种新的细胞纳米穿孔(cell nanoporation, CNP) 生物芯片:在密布直径500nm纳米孔道的芯片上培养单层的来源细胞(如鼠的成纤维细胞或树突状细胞),将整个装置孵育在目标质粒DNA的缓冲液中,给予定向电流后,细胞膜受到损伤,带负电的核酸质粒顺着电势差从纳米孔道中进入细胞内。
此后,细胞开始修复膜并将目标质粒转录为mRNA,同时大量分泌外泌体,以排出电流强制注入的外来质粒。然而,细胞不断抛出体外的“废物”正是研究者所需的包含目标mRNA的外泌体。外泌体分泌活动在电穿孔8h后达到峰值,并能持续24h以上。与传统的电穿孔(bulk electroporation)相比,CNP大大提高了外泌体产量,并将其中mRNA的载药量提高1000倍!
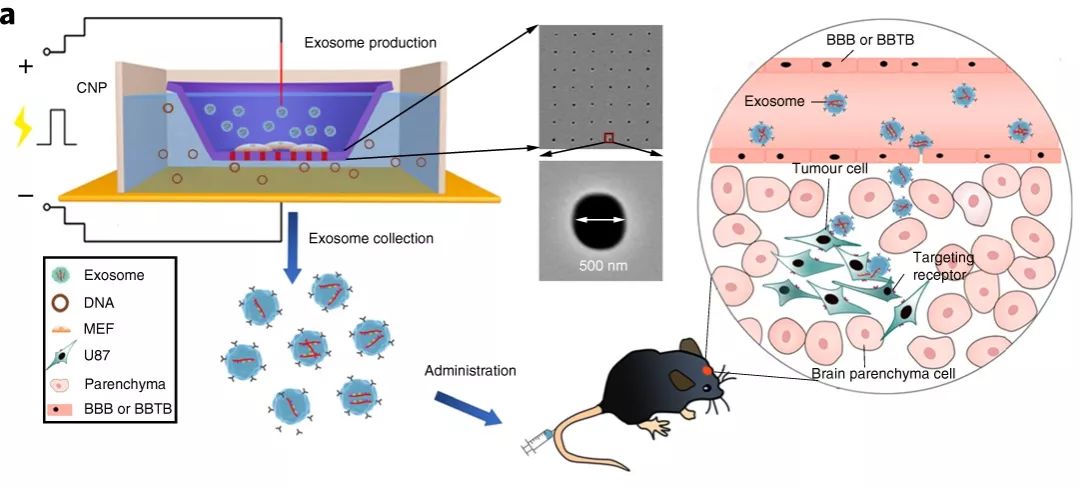
CNP法生产负载目标mRNA的外泌体
对于CNP触发外泌体释放的机制,研究者认为与纳米电穿孔导致的细胞外Ca2+内流有关,因为细胞为钙离子螯合剂EGTA能够减少外泌体的释放。并且,他们观察到纳米电流通道附近温度身高,热休克蛋白含量增加后激活p53-TSAP信号通路,从而促进外泌体释放。
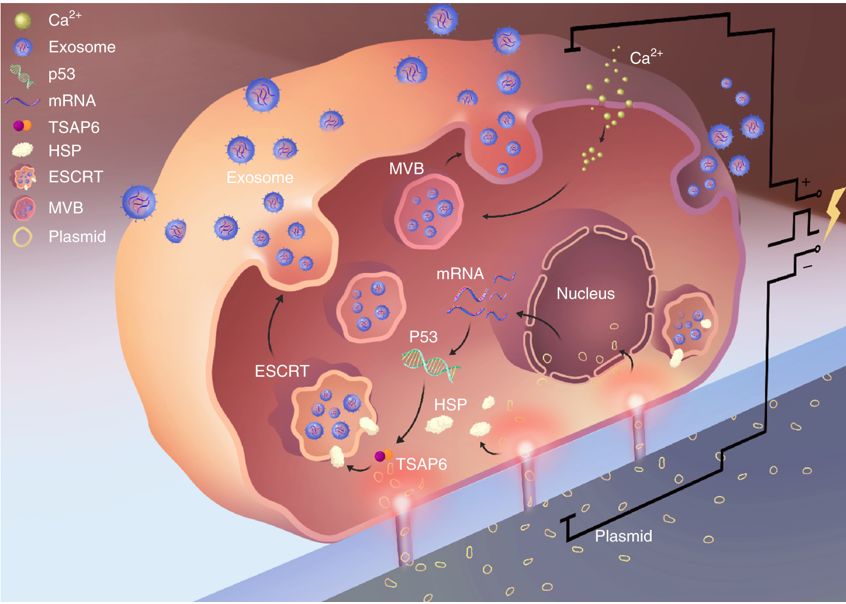
CNP触发外泌体释放的机制
研究者在外泌体膜表面富集的跨膜蛋白CD47末端克隆神经胶质瘤靶向肽,用CNP技术在其中包载抑癌基因PTEN, 重新启动突变的抑癌开关。他们发现PTEN缺陷型人U87胶质母细胞瘤细胞和小鼠GL261胶质瘤模型对CD47外泌体(Exo-T)对摄取显著增加。
进一步评估药代动力学,研究者发现过表达CD47的Exo-T在体内半衰期延长三倍,说明Exo-T在体内具有高度稳定性,能够进行更长时程的循环。提示Exo-T给药后维持有效的周期显著延长,可减小临床用药频率。
最后,研究者对Exo-T的体内疗效进行评估,较非靶向外泌体和TurboFect纳米载体,其穿透血脑屏障、靶向肿瘤富集的能力更强,肝脏和脾脏等其他器官的蓄积显著更低。实验组小鼠的平均生存时间为造膜后49天,较对照组的37天显著延长。
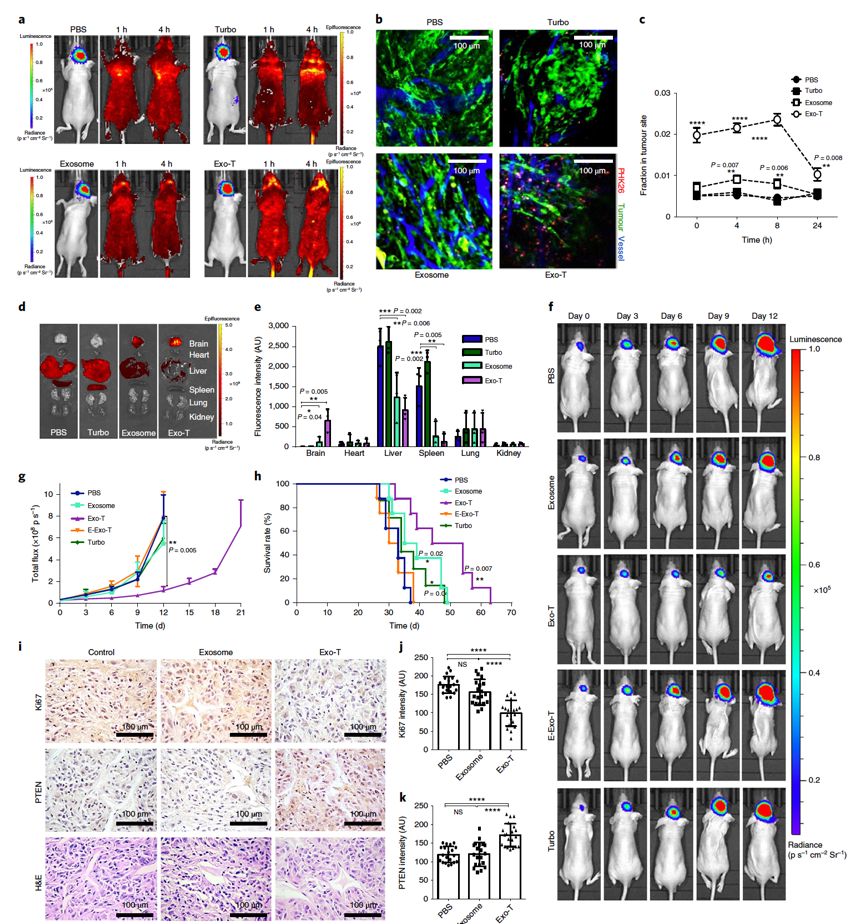
CNP法制备的CD47外泌体的U87胶质瘤鼠体内靶向性和疗效
Zhaogang Yang等人发明的细胞纳米穿孔法,颠覆传统先纯化后载药的外泌体制备方法,巧妙利用纳米电穿孔将两步骤合二为一,使细胞分泌的负载目标mRNA的外泌体,同时极大改善其产量、靶向性和适用性。目前,传统电穿孔法附载短干扰RNA的外泌体临床实验已在进行当中,而CNP技术展现出的高靶向、低毒性的数量级突破,提示更优异的外泌体基因治疗策略在临床广泛应用的转化可能性。
参考文献:
Zhaogang Yang et al. Large-scale generation of functional mRNA-encapsulating exosomes via cellular nanoporation. Nature Biomedical Engineering, 16 Dec, 2019.
推荐阅读:
-
Nature子刊:“跨界神药”二甲双胍能减肥,原来和它有关!
-
突破:RNA+DNA同时测序,检测癌症组织中的基因融合和碱基突变!
-
拜拜夜宵!Cell子刊证实限时饮食可显著改善代谢综合征患者健康指标
-
Nature:揭秘CAR-T疗法T细胞耗揭的关键原因,有望进一步攻克实体瘤
-
【Nature子刊】儿童癌症元凶:染色体外环状DNA?
-
Science子刊背靠背:阿尔茨海默症浮现新的诊断指标!
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录



还没有人评论,赶快抢个沙发