【PNAS】火起来的“相分离”又有新发现!或揭示阿尔茨海默氏病病因
| 导读 | tau蛋白是含量最高的微管相关蛋白,有助于稳定大脑中神经细胞(神经元)的内部骨架。然而,阿尔茨海默氏病(AD)患者大脑中的tau蛋白则异常过度磷酸化,从而形成有毒的tau蛋白(也称为tau寡聚体),并丧失正常生理功能。至今还没有科学家发现其中的确切机制。 |
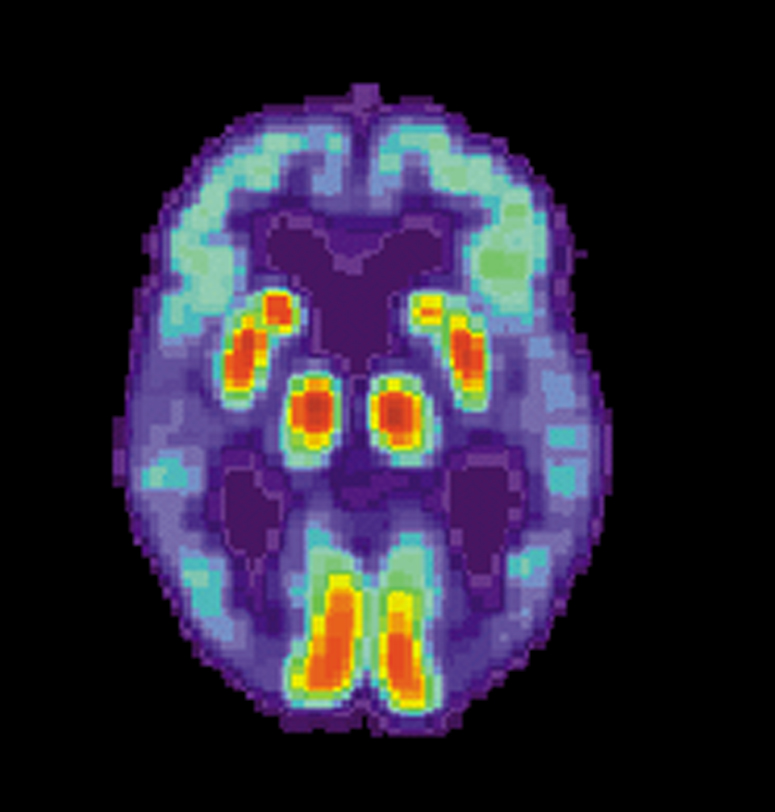
近几年,“相分离”(Phase separation)成为了一个新兴的生物学研究领域,已有研究表明,相分离在细胞中普遍存在,与基因组的组装、转录调控可能密切相关,相分离的失调可能是一些疾病(如神经/肌肉退行性疾病)发生的病因,相关领域的科学家也开始通过相分离视角重新审视相关疾病,通过干扰异常“相分离”来达到治疗相关疾病的目的。
近日,波士顿大学医学院(BUSM)的一项新研究发现“相分离”在这些tau寡聚体形成过程中起着关键作用,并揭示如何相应地预防这些有毒蛋白质的形成。该研究近期发表于《美国科学院院报》,题为“TIA1 potentiates tau phase separation and promotes generation of toxic oligomeric tau”。

这项研究基于生物学中一个新兴的研究领域,称为“相分离”,这种现象在液体之间是常见的,描述的是一种细胞里不同成分间相互碰撞、融合形成液滴,从而使一些成分被包裹在液滴内,一些成分被阻隔在液滴外的现象,类似于水油相混。该领域的兴起源于有科学家发现,蛋白质能够像“醋里的油”一样形成液滴。
而在这项研究中,研究小组发现含有TIA1蛋白(一种与阿尔茨海默氏病以及肌萎缩侧索硬化症有关的RNA结合蛋白)的液滴为形成有毒的tau寡聚体提供了基础。
先前的研究表明,重组tau蛋白在多阴离子试剂的存在下,在体外容易形成寡聚体,但是生成的tau寡聚体毒性并不高。在这项研究中,他们发现,在RNA和TIA1存在下,tau蛋白的相分离产生了丰富的tau寡聚体。与TIA1共分配过程中产生的tau寡聚体比单独与RNA孵育或与人工拥挤剂孵育产生的相分离tau寡聚体的毒性更大。
具体来说,研究人员将特定蛋白质混合在一起,然后在显微镜下观察形成的小液滴。令人惊讶的是,他们发现tau蛋白会在TIA1液滴内形成另一个液滴,并又与TIA1选择性地再形成液滴。而其他的RNA结合蛋白却不会刺激tau寡聚体的形成。
他们还检测了有毒tau寡聚体的数量,并显示TIA1液滴中的含有更多有毒tau寡聚体。研究表明,将tau蛋白与TIA1混合会产生对神经元非常致命的tau寡聚体。
研究结果回答了有关毒性tau蛋白形成的根本问题,并为筛选可抑制有毒tau寡聚体形成的化合物提供了有力工具。
总之,根据这项研究,tau和TIA1在病理学上同时出现,而TIA1是为数不多的与阿尔茨海默病基因相关的RNA结合蛋白之一,研究人员认为,这项发现将有助于推动药物开发,帮助筛选出防止tau寡聚体形成的潜在化合物。(转化医学网360zhyx.com)
参考资料:
【1】https://medicalxpress.com/news/2021-02-biochemical-responsible-toxic-tau.html
【2】https://www.pnas.org/content/118/9/e2014188118
【3】https://www.jianshu.com/p/74bda9d18b35
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发