【Science子刊】复旦肿瘤医院团队确定了三阴性乳腺癌的免疫治疗靶点!
| 导读 | 免疫治疗作为一种治疗肿瘤的新方法,近年来飞速发展,已经应用于多种肿瘤的临床治疗,并取得良好效果。缺少疗效预测指标等局限性,这也成为全球医学界亟需破解的难题之一。 |
乳腺癌的疾病分型多种多样,其中三阴性乳腺癌因预后极差被称为“乳腺癌之王”。免疫治疗作为一种治疗肿瘤的新方法,近年来飞速发展,已经应用于多种肿瘤的临床治疗,并取得良好效果。缺少疗效预测指标等局限性,这也成为全球医学界亟需破解的难题之一。复旦大学附属肿瘤医院的研究团队首次成功锁定基因“Lgals2”是三阴性乳腺癌介导免疫逃逸的“帮凶”,为三阴性乳腺癌的免疫治疗提供了新的方向。
近日,来自复旦大学附属肿瘤医院乳腺外科主任兼复旦大学肿瘤研究所所长邵志敏教授、精准肿瘤中心胡欣研究员、乳腺外科狄根红教授领衔的团队,结合三阴性乳腺癌多组学研究,首次成功锁定基因“Lgals2”是三阴性乳腺癌介导免疫逃逸的“帮凶”,相关研究发表在《SCIENCE ADVANCES》杂志上,题为“In vivo multidimensional CRISPR screens identify Lgals2 as an immunotherapy target in triple-negative breast cancer”。且有望成为三阴性乳腺癌免疫治疗新靶点,为三阴性乳腺癌的免疫治疗提供了新的方向。
 https://www.science.org/doi/10.1126/sciadv.abl8247
https://www.science.org/doi/10.1126/sciadv.abl8247
免疫逃逸
01
免疫治疗作为一种治疗肿瘤的新方法,近年来飞速发展,已经应用于多种肿瘤的临床治疗,并取得良好效果。然而,对于有“最毒乳腺癌”之称的三阴性乳腺癌,以靶向PD-1/ PD-L1为首的免疫治疗却依然存在受益人群有限、缺少疗效预测指标等局限性,这也成为全球医学界亟需破解的难题之一。
乳腺癌的生长与肿瘤免疫微环境和免疫逃逸的变化有关。在免疫逃逸过程中,免疫检查点阻断分子(如PD-1和PD-L1)的存在会降低CD8 + T细胞的肿瘤杀伤活性。PD-L1常见于三阴性乳腺癌(TNBC)患者的肿瘤细胞和/或肿瘤相关免疫细胞上。尽管与单独接受化疗的患者相比,使用检查点抑制剂阿替利珠单抗联合化疗的PD-L1阳性转移性TNBC患者的总生存期有所改善,但中位生存期仍刚刚超过2年,并且无进展生存期(PFS)仅略有改善。
“免疫医生”
02
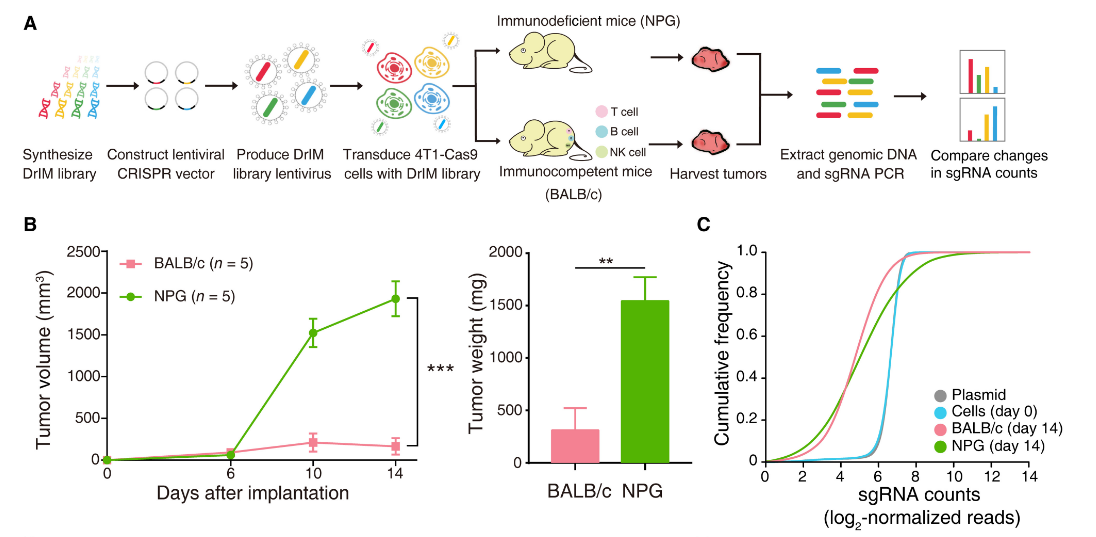
能否有效筛选并甄别肿瘤免疫基因,为肿瘤精准治疗奠定基础?为此,复旦大学附属肿瘤医院研究团队以三阴性乳腺癌为切入点,对2796个疾病相关免疫基因进行CRISPR/Cas9基因编辑,构建了“Dr. Immune”(免疫医生)文库。通过将导入文库的三阴性乳腺癌细胞分别种植到免疫力完整和免疫力重度缺陷的小鼠中,监测和分析肿瘤生长过程中富集或丢失的细胞。批量性观察在“肿瘤-免疫”的交互状态下,这些基因在小鼠体内究竟是参与免疫监视,还是免疫逃逸。
基于第一轮“免疫医生”的筛选,研究团队进一步升级,定制开发出更为精细的 “mini-Dr. Immune”(迷你免疫医生),放到设计更精妙的多维免疫状态下开展二轮筛选。通过一轮轮筛选的抽丝剥茧,发现同一基因在不同免疫状态下,对抗肿瘤的协同/拮抗作用可能是不同的,有的甚至截然相反。这个发现很好演绎了同样的免疫治疗在部分患者身上有效,但在部分患者身上无效的情况,这一情况很可能与患者本身的免疫状态有关。

锁定LGALS2
03
体内筛选表征了不同肿瘤微环境中的基因功能,并回收了Ido1等规范免疫治疗靶点。此外,功能筛选和转录组学分析确定Lgals2是TNBC中涉及免疫逃逸的候选调节因子。
在三阴性乳腺癌中是否是有关键分子,总是能“帮助”肿瘤细胞伪装,逃避免疫系统中各路免疫细胞的追杀呢?根据“免疫医生”的筛选结果,并基于复旦肿瘤乳腺团队邵志敏教授、江一舟教授等已开展的三阴性乳腺癌多组学研究,研究团队成功锁定LGALS2为三阴性乳腺癌介导免疫逃逸的关键分子。(转化医学网360zhyx.com)
参考资料:
https://www.science.org/doi/10.1126/sciadv.abl8247
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录



还没有人评论,赶快抢个沙发