新型抑制剂!发挥“一石二鸟”效应!可克服化疗耐药,改善胶质母细胞瘤治疗!
| 导读 | 替莫唑胺(TMZ)是胶质母细胞瘤(GBM)患者的标准治疗药物。然而,TMZ由于GBM细胞的化疗耐药而具有中等的治疗效果,其机制尚不明确。 |
近日,南京医科大学联合浙江大学研究人员在国际期刊《Nature Communications》上发表了题为“Hypoxanthine phosphoribosyl transferase 1 metabolizes temozolomide to activate AMPK for driving chemoresistance of glioblastomas”的研究论文,该研究证明了TMZ衍生的5-氨基咪唑-4-甲酰胺(AICA)在GBM细胞中转化为AICA核糖基-5-磷酸(AICAR)。这种转化由次黄嘌呤磷酸核糖转移酶1 (HPRT1)催化,HPRT1在人胶质母细胞瘤中高表达。替莫唑胺衍生的AICAR作为腺苷酸活化蛋白激酶(AMPK)的真正激活剂,激活AMPK磷酸化核糖核苷酸还原酶(RNR)的催化亚基RRM1的苏氨酸52 (T52),导致RNR活化和dntp生成增加,以促进替莫唑胺诱导的DNA损伤修复。RRM1 T52A的表达,HPRT1介导的AICAR产生的基因中断,或6-巯基嘌呤(6-MP,一种临床批准的HPRT1抑制剂)的使用,可阻断TMZ诱导的AMPK激活,并使小鼠脑肿瘤细胞对TMZ治疗敏感。此外,在接受TMZ治疗的GBM患者中,HPRT1表达水平与不良预后呈正相关。这些结果揭示了TMZ在GBM治疗中导致化疗耐药的关键双重功能作用。本研究结果强调了联合使用临床可用的6-MP来克服TMZ化疗耐药和改善GBM治疗的潜力。

https://www.nature.com/articles/s41467-023-41663-2
研究背景
01
胶质母细胞瘤(GBM)是一种四级胶质瘤,是成人最常见的原发性恶性脑肿瘤,也是中枢神经系统最致命的癌症。替莫唑胺(Temozolomide, TMZ)是唯一一种被证实能改善GBM患者总体生存的化疗药物。标准疗程后的中位生存期仍然只有12-15个月。TMZ是一种小的亲脂性前药,经过自发水解成为活性代谢物单甲基三氮烯5-(3-甲基三氮烯-1-基)-咪唑-4-羧酰胺(MTIC)。MTIC进一步与水反应,释放5-氨基咪唑-4-羧酰胺(AICA)和甲基重氮离子;后者将甲基传递给DNA的嘌呤碱基。甲基化嘌呤,特别是O6-甲基鸟嘌呤,导致单链和双链DNA断裂和细胞周期阻滞,最终导致肿瘤细胞死亡。
内在和获得性TMZ耐药是GBM治疗的主要临床挑战。TMZ化学耐药主要归因于O-6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)介导的TMZ-诱导DNA甲基加合物的去除和DNA损伤修复系统的激活,如错配修复、碱基切除修复、非同源末端连接(NHEJ)和同源重组(HR)修复。适当的DNA损伤修复需要足够的脱氧核糖核苷三磷酸(dNTPs),这是由核糖核苷酸还原酶(RNR)介导的核糖核苷二磷酸(ndp)还原引起的脱氧核糖核苷二磷酸(dNDPs)产生的,核糖核苷酸还原酶(RNR)是dNTP生物合成新途径中的关键酶。深入的研究集中在TMZ衍生的甲基重氮离子的调控上。然而,TMZ衍生的AICA是否在TMZ化疗耐药中起作用尚不清楚。
研究过程
02
在本报告中,研究人员揭示了TMZ在GBM治疗中的关键双重功能作用。TMZ衍生的甲基重氮离子产生甲基化嘌呤,导致DNA损伤。然而,TMZ衍生的AICA通过促进DNA损伤修复来抵消甲基化嘌呤介导的DNA损伤。机制上,TMZ代谢物AICA被HPRT1转化为AICAR,激活AMPK并导致AMPK介导的RRM1在T52位点磷酸化。这种磷酸化增加了ATP与RRM1的结合亲和力,激活了RNR,随后增加了用于DNA损伤修复的dNTPs的产生。由于6-MP对HPRT1具有相当高的亲和力,6-MP通过竞争性抑制AICA与HPRT1的结合破坏了“屏障”。通过HPRT1缺失或6-MP处理抑制HPRT1介导的AICA催化和RRM1 T52A的表达,通过减弱DNA损伤修复,加重TMZ诱导的DNA损伤,导致小鼠细胞凋亡增加和GBM对TMZ处理的敏化。
在这项研究中,研究人员证明了AMPK磷酸化并激活RNR以促进dNTP的产生,这很可能促进了HR对TMZ耐药的修复,因为HR修复消耗大量的dNTP。另一方面,AMPK可能通过磷酸化并激活53BP1而激活NHEJ,从而促进TMZ耐药。综上所述,研究人员提出AMPK协同多层次机制促进TMZ耐药。
在本研究中,研究人员证明了HPRT1介导tmz衍生的AICA产生AICAR,从而激活AMPK,通过磷酸化和激活RRM1来促进核苷酸合成。这一机制揭示了HPRT1在TMZ诱导的DNA损伤之前获得GBM细胞的关键作用。因此,研究人员认为MGMT-和hprt1介导的修复过程是TMZ诱导的DNA损伤的两层调控。
药物6-MP目前被用于治疗ALL和CML。除了这种已建立的抗癌功能外,研究人员还发现6-MP有效地阻断了TMZ衍生的AICAR的产生。因此,本研究揭示了6-MP对GBM治疗的“一石二鸟”效应。重要的是,研究人员发现TMZ代谢物AICA是HPRT1的真正底物,并在TMZ治疗下转化为AMPK激活剂AICAR,促进肿瘤细胞存活。
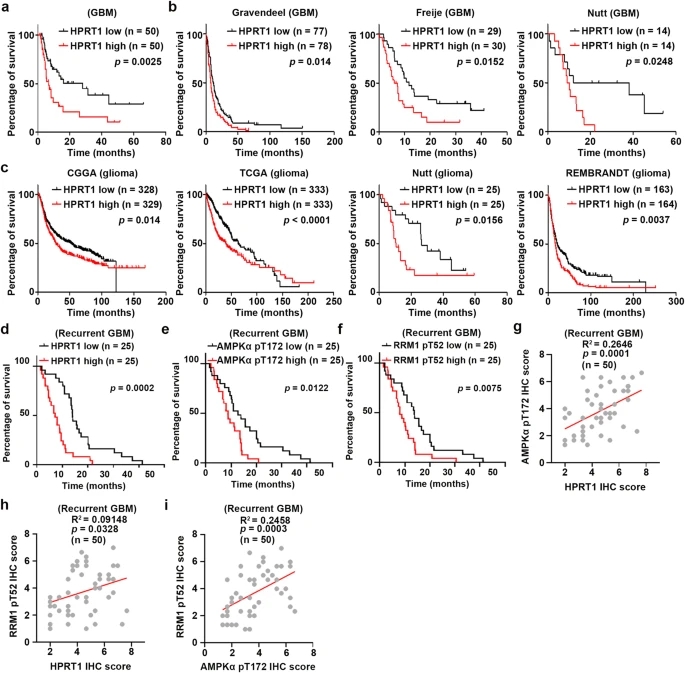
HPRT1高表达预示GBM患者预后不良
研究结论
03
综上所述,本研究表明6-MP和TMZ联合治疗在抑制脑肿瘤生长方面的协同作用强调了联合使用目前临床可用的药物6-MP克服TMZ耐药和改善GBM治疗的潜力。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41467-023-41663-2
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录



还没有人评论,赶快抢个沙发