【Nature子刊】上海交通大学朱军/蔡瑜团队:神经胶质瘤有前景的治疗靶点
| 导读 | 胶质瘤新靶点的发现具有重要意义。本研究旨在探讨ORC6 (origin recognition complex 6)在胶质瘤中的表达模式、生物学功能和潜在机制。 |
7月6日,上海交通大学朱军/蔡瑜研究团队在期刊《Cell Death&Disease》上发表了研究论文,题为“Origin recognition complex 6 overexpression promotes growth of glioma cells”。本研究中,研究人员通过生物信息学分析,发现在人脑瘤组织中ORC6表达显著增加,与总体生存率较差、肿瘤分级较高以及野生型异柠檬酸脱氢酶状态相关。此外,研究人员在接受局部治疗的患者的脑瘤组织以及多种原发性/已建立的脑瘤细胞中均检测到了ORC6的过表达。进一步的生物信息学分析揭示,与ORC6共表达的基因在与癌症相关的多个信号通路中富集。在原发性和永生化(A172)脑瘤细胞中,通过特异性shRNA或Cas9-sgRNA敲除(KO)降低ORC6表达显著降低了细胞活力和增殖,扰乱了细胞周期进程和迁移能力,并触发了细胞凋亡。相反,通过一种慢病毒载体增强ORC6表达在人脑瘤细胞中增强了恶性行为。总之,RBPJ驱动的ORC6过表达促进了胶质瘤细胞的生长,凸显了其作为潜在治疗靶点的重要性。

https://www.nature.com/articles/s41419-024-06764-w#Sec30
背景知识
01
胶质瘤是一种源于胶质细胞的异质性肿瘤谱。它涵盖了星形胶质瘤、少突胶质瘤、室管膜瘤和混合胶质瘤等,每种都需要不同的治疗方法。根据其侵袭性和对当前治疗方法的抵抗力,胶质瘤被分为从I到IV的不同级别,这给治疗带来了重大挑战。通常的治疗方法包括手术、放疗和化疗(主要为替莫唑胺),这些治疗方法的选择取决于肿瘤的位置、组织学、基因型和患者的整体健康状况等因素。特别是对于胶质母细胞瘤(GBM)的治疗尤其具有挑战性,治疗效果有限,这推动了对创新疗法的研究,如靶向分子治疗、免疫治疗和先进的药物递送系统。
胶质瘤的靶向治疗采用针对肿瘤生长和进展过程中的关键分子异常或途径的定制治疗策略。这些策略包括针对包括EGFR扩增、VEGFR过表达/过度激活以及异柠檬酸脱氢酶1和2(IDH1和IDH2)突变等异常的药物。免疫治疗药物,包括PD-1/PD-L1抗体/抑制剂,旨在增强免疫系统对抗胶质瘤细胞的反应。然而,由于胶质瘤的异质性、适应性耐药机制以及难以逾越的血脑屏障,这些治疗仍面临挑战。发现新的胶质瘤治疗靶点具有重大意义。
起始识别复合体(ORC)是真核细胞中的一种多亚基蛋白质复合物,在DNA复制起始过程中起着关键作用。ORC由6个亚基(ORC1-ORC6)组成,负责识别和结合特定的DNA复制起始位点,从而启动前复制复合物的组装。作为一种支架蛋白,ORC招募了DNA复制起始和进程所必需的必要成分,确保细胞分裂过程中DNA的精确复制。ORC的扰动可能导致DNA复制和基因组稳定性的紊乱,这可能促进癌症的发生和发展。在ORC中,ORC6对于识别精确的DNA复制起始位点至关重要。其作用包括协调在细胞分裂过程中精确复制DNA所需蛋白质的组装。ORC6表达或功能的异常与多种癌症类型有关,导致细胞增殖增加,并可能影响某些癌症(如乳腺癌、肺癌、结直肠癌和肝细胞癌)的不良预后。
ORC6在胶质母细胞瘤中潜在的功能角色探索
02
通过对TCGA-GBM数据集的全面分析,研究人员探究了ORC6在GBM中的可能功能作用。皮尔逊相关性分析确定了与ORC6显著相关的779个基因,而高、低ORC6表达组之间的差异表达分析则发现了793个差异表达基因(DEGs)。这些数据集的交集指出了与ORC6在GBM中相关的95个共同基因。利用基因本体(GO)对这些共同基因进行功能分析,预测了ORC6可能参与“调控细胞核分裂”、“调控细胞核分裂”、“纺锤体装配检查点信号通路”、“有丝分裂纺锤体装配检查点信号通路”等过程。此外,京都基因与基因组百科全书(KEGG)分析强调了ORC6在“细胞周期”、“细胞衰老”和其他信号通路中的重要性。值得注意的是,ORC6与关键的致癌基因,包括CCNA2和CCNB2以及TOP2A以及增殖标记基因MKI67显示出强烈的正相关性。这些研究结果共同表明,ORC6可能在胶质母细胞瘤中发挥功能作用,暗示其可能参与细胞周期调控、细胞增殖和有丝分裂调控。
ORC6蛋白能够抑制颅内患者来源的胶质瘤异种移植瘤在裸鼠体内的生长
03
为了研究ORC6在体内肿瘤细胞生长中的潜在作用,研究人员将表达CRISPR/Cas9-ORC6-KO构建体(“koORC6”)或Cas9-C控制(“Cas9-C”)的P1胶质瘤细胞通过颅内注射注入裸鼠脑内。利用MRI监测肿瘤。20天后,Cas9-C组的第一只小鼠出现了明显的症状。随后,对颅内异种移植物进行了测量。结果显示,与Cas9-C组颅内P1胶质瘤异种移植物相比,koORC6组颅内P1胶质瘤异种移植物明显较小。在小鼠体重方面未观察到显著差异。koORC6颅内P1胶质瘤异种移植物组织中ORC6的mRNA和蛋白质表达显著降低,而ORC2的mRNA和蛋白质表达水平保持不变。量化的Ki-67 IHC染色结果显示,koORC6颅内P1胶质瘤异种移植物组织切片中观察到的核Ki-67染色比例降低,支持了细胞增殖的抑制。后续的研究揭示,在koORC6 P1胶质瘤异种移植组织中,Cyclin A2、Cyclin B2和TOP2A的mRNA和蛋白表达水平显著降低,同时检测到较高的cleaved-caspase-3、cleaved-caspase-9和cleaved-PARP-1水平,表明激活了细胞凋亡。这些综合发现强烈表明,ORC6敲除抑制了裸鼠颅内P1胶质瘤异种移植瘤的生长。
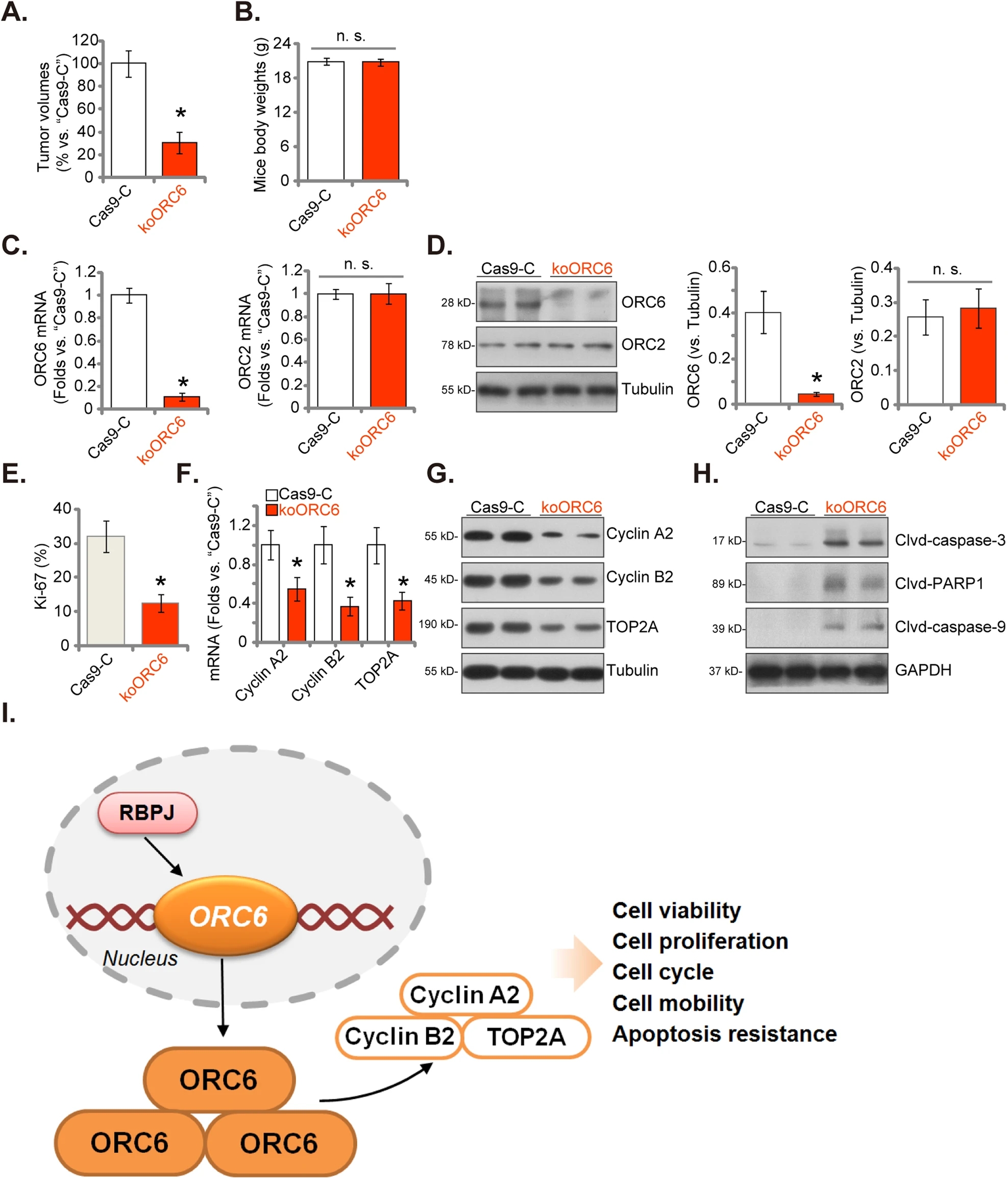
ORC6蛋白能够抑制颅内患者来源的胶质瘤异种移植瘤在裸鼠体内的生长
研究结论
04
本研究探索了导致人类胶质瘤中ORC6表达增加的潜在机制,强调了转录因子RBPJ的关键作用。研究表明,RBPJ通过增强IL-6-STAT3通路和神经前体-间充质转化(PMT)促进GBM细胞增殖、侵袭、干细胞特性和肿瘤发生。研究报告表明,RBPJ与CKD9结合促进转录延伸并维持脑肿瘤起始细胞。在P1胶质瘤细胞中,通过使用慢病毒shRNA实验性降低RBPJ表达导致ORC6表达在mRNA和蛋白质水平上均降低。相反,通过慢病毒构建物提高RBPJ表达导致ORC6表达增加。值得注意的是,本研究发现,在各种胶质瘤组织和原代/永生化胶质瘤细胞中,RBPJ蛋白与ORC6启动子区域的结合强度增强。因此,RBPJ-ORC6启动子增强的结合可能代表了人类胶质瘤中ORC6表达增加的关键机制。总之,RBPJ驱动的ORC6过表达促进了胶质瘤细胞的生长,凸显了其作为潜在治疗靶点的重要性。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-024-06764-w#Sec30
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发