【Nature子刊】中山大学肖海鹏团队新发现:神经递质降钙素或成为抑制甲状腺髓样癌的关键!
| 导读 | 在本研究中,团队比较了MTC和甲状腺状癌(PTC)的单细胞景观,发现MTC中CGRP的表达与树突状细胞(DC)异常发育有关,其特征是cAMP相关通路的激活和高水平的克虏伯样因子2(KLF2),与肿瘤浸润T细胞的活性受损相关。 |
2024年7月19日,中山大学附属第一医院内分泌科肖海鹏团队在期刊《Nature Communications》上发表了题为“The neurotransmitter calcitonin gene-related peptide shapes an immunosuppressive microenvironment in medullary thyroid cancer”的研究论文。本研究提供了对MTC免疫抑制微环境的见解,并提出CGRP受体,可以作为潜在的治疗靶点。

https://www.nature.com/articles/s41467-024-49824-7#Sec10
研究背景
01
神经免疫学是一个新兴领域,它连接了两个主要系统,即神经系统和免疫。神经免疫学的最新进展,揭示了神经递质在癌症进展中的肿瘤促进功能。例如,黑色素瘤中的伤害感受器神经元,通过释放降钙素基因相关肽(CGRP),促进肿瘤浸润性T细胞的耗竭。
神经内分泌肿瘤(NET)可能是研究神经递质在人类肿瘤中潜在作用的合适模型。神经内分泌瘤是常见于肺、胃肠道和甲状腺的上皮性恶性肿瘤,可分泌各种类型的激素和神经递质,如胰岛素、5-羟色胺、降钙素和CGRP4。甲状腺髓样癌(MTC)是一种起源于甲状腺滤泡旁细胞的神经内分泌瘤。与最常见的甲状腺状癌(PTC)不同,其5年生存率超过90%。美国甲状腺协会建议,使用多靶点酪氨酸激酶抑制剂(TKI)凡德他尼和卡博替尼治疗晚期MTC。然而,TKI治疗伴随着显著的高不良反应发生率(38.9-72%),以及对长期治疗的耐药性这一常见问题,需要长期随访和更深入的机制研究。因此,研究MTC的新治疗靶点至关重要。
CGRP是降钙素的转录剪接产物,已在MTC的肿瘤和外周血清中发现。然而,人们对CGRP如何影响MTC微环境知之甚少。Pozdeyev在2020年发表的一项使用mIHC的研究表明,MTC中49%的原发性病变,表现出免疫浸润(大部分分散或聚集在肿瘤周围,14.6%的病例在肿瘤内观察到)。
在本研究中,团队对7名MTC患者和8名PTC患者的肿瘤、邻近正常甲状腺组织和外周血单核细胞(PBMC),进行了单细胞RNA测序分析,报告了单细胞分辨率下MTC的免疫抑制微环境。恶性细胞分泌CGRP可以通过阻碍负调节因子克虏伯样因子2(KLF2)的下调,来破坏瘤内树突状细胞(DC)的发育。目前的研究,提供了对MTC免疫抑制微环境的见解,以及神经递质CGRP对肿瘤影响的人类证据,提出了CGRP受体作为MTC的有前途的治疗靶点。
研究进展
02
人类甲状腺癌单细胞景观显示,
MTC中的免疫浸润率低
为了生成人类甲状腺癌肿瘤微环境的全面转录谱,团队对肿瘤组织进行了单细胞RNA测序,并配对了15名初治患者的正常甲状腺组织,包括7名MTC和8名PTC。团队对来自肿瘤和邻近正常组织的228,400个细胞,进行了无监督聚类和均匀流形近似和投影(UMAP)分析。使用每个簇的特征基因,包括众所周知的注释标记,团队鉴定了主要细胞类型,包括T细胞、B细胞、血浆、髓样细胞、增殖细胞、滤泡上皮细胞、滤泡旁细胞、成纤维细胞和内皮细胞。团队还分析了从10份外周血样本中分离的细胞。
甲状腺分化评分(TDS)计算,验证了PTC肿瘤细胞的分化程度低于正常滤泡上皮细胞,表明肿瘤细胞在肿瘤发生中经历了去分化。
根据PTC和MTC之间主要细胞类型的富集比分析,团队发现,包括T细胞、B细胞、血浆和髓样细胞在内的所有免疫细胞均优先分布于PTC,基底细胞在MTC中表现出相对富集。转录组学分析还表明,与队列或癌症基因组图谱计划 (TCGA) 队列的PTC相比,MTC的免疫浸润评分显著降低,表明免疫细胞分布较少。使用免疫组化(IHC)染色,与PTC相比,在MTC肿瘤区域发现的CD45细胞更少。与肿瘤相比,来自PTC或MTC患者的外周血样本具有相似的免疫细胞组成,这表明在肿瘤中观察到的不同微环境,不归因于全身免疫疾病。单细胞图谱表明,MTC可以被识别为一种免疫“冷”肿瘤。
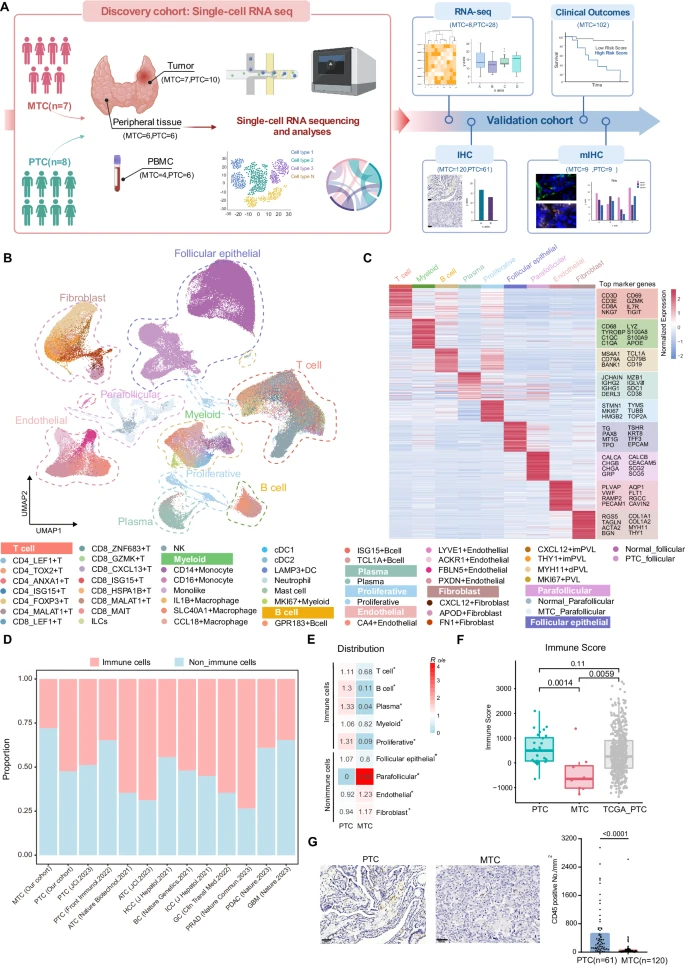
人类甲状腺癌单细胞景观显示MTC的免疫浸润率低。
受CGRP影响的功能失调的DC,
负责诱导MTC中CD8 T细胞的抑制特性
团队进行了涉及CGRP和CD8T细胞的体外实验,以探讨MTC微环境中CD8 T细胞的特性,是否直接受到CGRP的影响。结果显示,长期暴露于CGRP,不影响T细胞增殖或其功能分子的表达。
巨噬细胞也是一个重要的髓系细胞群,具有除DC以外的抗原呈递和免疫调节作用。CCL18巨噬细胞可能是一种具有一定免疫抑制功能的亚型,因为它们的免疫抑制相关基因得分在3种亚型中最高。所有3种亚型的巨噬细胞,在PTC肿瘤中都相对更丰富。MTC中巨噬细胞的M1和M2评分均略低于PTC。两种类型的肿瘤之间巨噬细胞缺乏显著差异,这表明巨噬细胞可能不是原代细胞群,导致MTC和PTC的免疫反应显著不同。
DC是唯一在细胞比例、抗原呈递和共刺激功能方面,与CD8 T细胞活化水平呈正相关的细胞群。功能失调的DC,可能是T细胞反应减弱的原因。CGRP在肿瘤中的表达水平,与免疫微环境中DCs的免疫浸润评分、细胞毒性评分、CD8 T细胞耗竭评分和共刺激功能评分呈负相关。综上所述,团队揭示了受CGRP影响的功能失调的DC,在塑造MTC免疫抑制微环境中的关键作用。
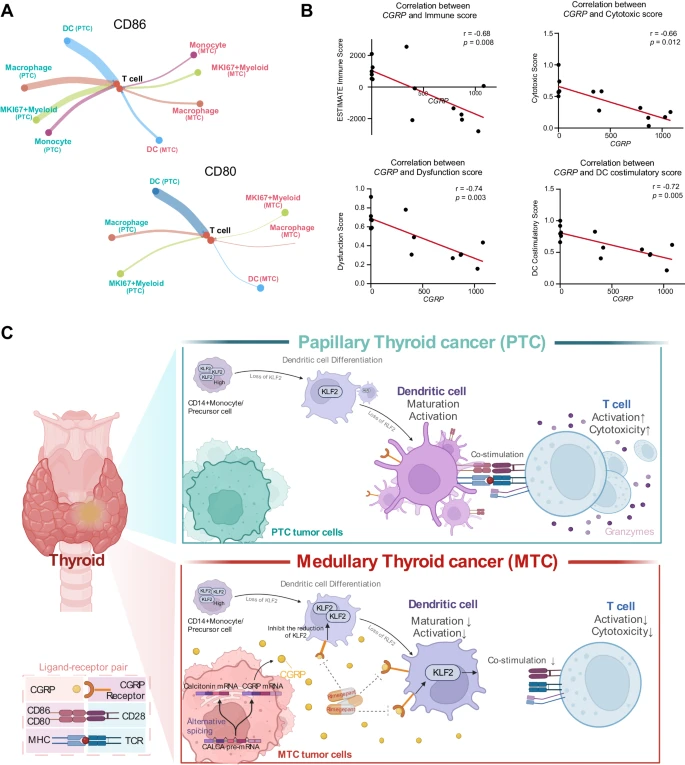
受CGRP影响的功能失调的DC负责诱导MTC中CD8 T细胞的抑制特性。
研究结论
03
在本研究中,团队绘制了MTC的综合单细胞景观,揭示了免疫抑制微环境。此外,团队证明了CGRP可以破坏肿瘤内DC的发育,并报告了CGRP在DC发育过程中,阻止负调节因子KLF2下调的机制。
在本研究中,团队展示了MTC的全面单细胞景观,与PTC以及其他一些常见癌症和已知的“免疫感冒”癌症相比,MTC中的免疫浸润较低,这与之前MTC IHC研究中,淋巴细胞数量的减少一致。众所周知,根据免疫细胞浸润的模式,肿瘤的免疫微环境,可以表征为发炎(高免疫浸润)、寒冷(低免疫浸润)和排除(免疫浸润仅位于肿瘤边缘)表型。MTC肿瘤中所有类型的免疫细胞均减少,但与邻近的正常组织相比,仍观察到增加。这表明MTC是一种“免疫冷”肿瘤,而不是抑制免疫细胞功能和通过外周基质细胞迁移的“免疫排斥”肿瘤。
为了研究CGRP在免疫调节中的作用,团队进行了细胞间通讯分析和多免疫组织化学染色,发现肿瘤产生的CGRP,通过CGRP受体CALCRL影响DC。团队发现,来自MTC的DC中cAMP通路的激活水平较高,并通过无监督重聚对DC进行进一步研究,揭示了MTC中DC的功能失调和耐受状态,其特征是与PTC相比,抗原呈递和共刺激功能降低。MTC中DCs的发展,与PTC中DCs的发展有很大不同,表明CGRP可能驱动DCs的异常发展。使用CellOracle进一步分析,揭示了关键转录因子KLF2在DCs异常发育轨迹中的变化。KLF2表达随着DC的正常发育过程逐渐降低,正如在PTC中观察到的那样。相比之下,MTC中KLF2表达水平的下降速度要慢得多。在从单核细胞到DCs的分化过程中,KLF2迅速下调,而CGRP的存在减缓了KLF2的丢失,并最终破坏了感受态DCs的发育。当团队使用cAMP抑制剂SQ22536抑制下游cAMP通路激活时,CGRP影响的KLF2表达降低,抑制的DC功能恢复。
团队的研究结果为MTC提供了转化相关性,因为它将支持RET激酶抑制剂与RET突变MTC免疫检查点抑制剂联合试验的基本原理。另一方面,值得注意的是,团队还发现,CGRP受体拮抗剂Rimegepant可以阻断CGRP的作用,并恢复功能性DC。Rimegepant是美国食品和药物管理局(FDA)批准的用于预防和治疗偏头痛症状的药物。在临床实践中,它被认为耐受性良好且安全。除MTC外,据报道CGRP在其他类型的神经内分泌癌(如小细胞肺癌、嗜铬细胞瘤和神经内分泌前列腺癌)中也有表达。因此,了解CGRP是否也调节这些肿瘤的微环境,将是很有趣的。
总之,团队生成了全面的MTC单细胞图谱,证明了神经递质CGRP在塑造免疫抑制性肿瘤微环境中的关键作用。值得注意的是,CGRP通过激活cAMP通路和防止转录因子KLF2的丢失,来驱动肿瘤内DC的异常发展。这些结果可能有助于开发有效的MTC疗法,并为CGRP在神经系统外的功能,提供人类证据。
参考资料:
1.Schiller, M., Ben-Shaanan, T. L. & Rolls, A. Neuronal regulation of immunity: why, how and where? Nat. Rev. Immunol. 21, 20–36 (2021).
2.Balood, M. et al. Nociceptor neurons affect cancer immunosurveillance. Nature 611, 405–412 (2022).
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发