喜讯!清华大学免疫所董晨课题组发现肿瘤免疫治疗新靶点
| 导读 | 近日,清华大学免疫所董晨课题组在《Immunity》上发表文章,报告他们所发现的肿瘤免疫治疗的新靶点,有望进一步改善目前anti-PD-1免疫治疗的疗效。 |
该论文深入研究了免疫调节点分子B7S1对抗肿瘤免疫反应中的负调节功能, 揭示了肿瘤微环境中表达于抗原呈递细胞的B7S1可启动CD8+效应T细胞的衰竭过程,并且与PD-1抑制性信号一起协同地诱导T细胞衰竭,阻断B7S1信号有望进一步改善现有anti-PD-1免疫治疗的疗效。

近年来, 肿瘤免疫治疗蓬勃发展, 已经给人类彻底战胜癌症带来了一线曙光。CD8+ T细胞是免疫系统攻击癌症细胞的主要利器。但是在肿瘤微环境里,CD8+ T细胞经常会进入机能缺陷或衰竭状态,从而不能有效地阻止癌症的进展。肿瘤细胞表面上调的抑制性配体PD-L1(Programmed Death-Ligand 1)与CD8+ T细胞上PD-1(Programmed Death-1)的相互作用是介导T细胞衰竭的机制之一;阻断PD-1/PD-L1通路的药物在癌症病人中疗效优于传统治疗手段,并已获FDA批准用于多种癌症的治疗。然而,在大部分癌症类型中,只有小部分病人(20~30%)对anti-PD-1/PD-L1免疫治疗产生应答,非应答者一般经历体内T细胞功能短暂激活后疾病继续进展。因此, 肿瘤微环境PD-1可能与其他分子一起协同地促进T细胞衰竭。
B7 superfamily member 1(B7S1),也称B7-H4、B7x或VTCN1,在2003年被董晨、陈列平和James P. Allison三个实验室几乎同时发现为T细胞的共抑制分子。B7S1过度表达于多种癌症,因此有可能是肿瘤免疫治疗的潜在靶点。在本项研究中, 董晨课题组首先在肝细胞癌(HCC)病人的临床标本中检测B7S1及其受体的表达。在肿瘤微环境中,B7S1高表达于抗原呈递细胞(APC),而它的潜在受体高表达于抗肿瘤效应淋巴细胞,PD-L1则主要表达于肿瘤细胞上,而且HCC病人肿瘤中CD8+ T细胞的功能缺陷与B7S1(而非PD-L1)的表达水平相关。
接着,他们在小鼠肿瘤模型中进一步验证B7S1在抗肿瘤免疫反应中的功能。他们发现阻断B7S1信号通路(B7S1敲除或anti-B7S1治疗)可抑制小鼠HCC (Hepa1-6)和淋巴瘤(A20、E.G7)的进展,在小鼠肿瘤中B7S1的受体(B7S1R)主要表达于CD8+ T细胞,而B7S1信号主要通过抑制APC和CD8+ T细胞的相互作用来实现免疫抑制。然后,他们利用E.G7小鼠模型来研究B7S1信号产生免疫抑制的机制。首先,他们分析了肿瘤中表达B7S1R的CD8+ T细胞的功能状态。B7S1R随着CD8+ T细胞向肿瘤浸润或扩增而上调,在第12天达到最高点后下降,并与PD-1(而非Tim-3)共表达。体内表型分析和RNA-seq分析表明,PD-1+B7S1R+Tim-3-CD8+T细胞处于激活状态,而PD-1+B7S1R-Tim-3+CD8+T细胞处于衰竭状态。通过对比野生型小鼠和B7S1敲除小鼠的表型,他们发现阻断B7S1信号通路可显著提高肿瘤浸润的CD8+ T细胞的数量和效应功能,并抑制T细胞衰竭的进程。体内外功能性实验表明,与T细胞衰竭密切相关的转录因子Eomes直接参与B7S1信号介导的免疫抑制。
由于B7S1R和PD-1共表达于肿瘤微环境中的CD8+ T细胞,而且阻断B7S1信号会导致PD-1的补偿性上调,董晨课题组猜测B7S1和PD-1信号可能会共同促进T细胞衰竭,同时阻断这两个通路可能会进一步增强抗肿瘤免疫力。于是他们对比了anti-B7S1、anti-PD-1单独用药和联合用药在E.G7和Hepa1-6小鼠肿瘤模型中的抑癌效果,研究结果表明,anti-B7S1和anti-PD-1联合治疗可更显著地抑制肿瘤生长。为研究联合治疗产生协同效应的机制,他们对比了经对照抗体、anti-B7S1、anti-PD-1和anti-B7S1+anti-PD-1治疗的小鼠中肿瘤抗原特异性CD8+ TIL的染色质开放区域(ATAC-seq)和转录组(RNA-seq)。CD8+ T细胞内大部分表观遗传修饰、基因表达以及信号通路由B7S1R和PD-1共同调控,表达于同一种细胞类型的B7S1R和PD-1可能通过作用于共同的下游信号分子来协同地抑制抗肿瘤CD8+ T细胞的功能,为anti-PD-1免疫治疗在癌症病人中应答率低的现象提供了理论依据。anti-B7S1和anti-PD-1治疗可进一步提高CD8+ TIL的效应功能和增殖存活能力,因此,在临床应用中,anti-B7S1和anti-PD-1联合用药有望进一步改善目前anti-PD-1免疫治疗的疗效。
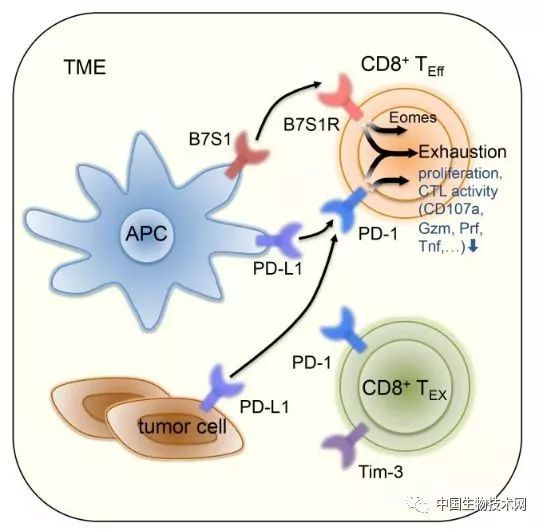
B7S1和PD-1信号共同促进T细胞衰竭
共表达于肿瘤内CD8+ T细胞的PD-1和B7S1R可接收来自于肿瘤细胞或APC的抑制性信号,通过作用于共同的下游信号分子来诱导T细胞衰竭。
董晨教授为本文的通讯作者,清华大学医学院博士生黎静为该论文的第一作者,论文其他合作者还包括来自清华大学、美国安德森癌症研究中心、美国西南医学院、多伦多大学和中日友好医院的研究者。该研究得到了北京市科学技术委员会、国家自然科学基金委等的资助。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发