胰腺中的“微生物群”竟成胰腺癌“帮凶”
| 导读 | 发表于《Cancer Discovery》的一项研究发现了一种微生物群,它在胰腺癌中显著存在且数量众多,可以通过与选择性Toll样受体结合使T细胞无反应,进而导致免疫耐受,而“狙击”这种微生物群可以阻止肿瘤发生,逆转肿瘤产生的免疫耐受。 |
胰腺癌在癌症中相对少见,发病率约占所有癌症的 3%,但这看似不高的发病,却无法阻止它戴上“癌症之王”的桂冠,占外分泌胰腺癌 80-90% 的侵袭性胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDA)是最具侵袭性的肿瘤,它病程隐蔽,临床症状出现晚,生长迅速,患者通常预后不良,缺乏有效的治疗手段。目前针对胰腺癌的标准疗法为化疗,少数情况下可以手术切除,但晚期患者的五年存活率仅有 7% ,因此全世界都迫切需要对胰腺癌的深入研究。
2018年3月Smruti Pushalkar等人,在《Cancer Discovery》上发表了一篇论文,科研人员们发现与健康的胰腺相比,癌变的胰腺中含有明显而丰富的微生物群。与肠道微生物相比,这些在胰腺肿瘤中的微生物差异性增大,且消除这些微生物群可以避免侵入性和侵袭性的胰腺导管腺癌(PDA)。在单核细胞中,PDA微生物群通过差异性激活选择性Toll样受体产生免疫耐受程序。这些数据表明,内源性微生物群会促使PDA特征的免疫抑制“瘫痪”,并认为微生物群在调节疾病进展的过程中具有治疗靶点的潜力。
消除胰腺肿瘤内的微生物群
对胰腺癌的治疗大有裨益
科研人员将具有荧光标记的肠球菌排泄物口服灌胃给野生型(WT)小鼠。表示微生物迁移进入胰腺,预示肠道微生物可以直接影响胰腺微环境。
16S rRNA 实验结果表明患有PDA的小鼠和人相较于正常情况明显存在该微生物群,且经qPCR分析证实,与正常相比,患有PDA的小鼠和人的微生物群丰度增加。
为了确定微生物是否导致胰腺发育不良,他们使用发育缓慢的胰腺癌KC模型。 无菌KC小鼠抵御了疾病的发展和间质扩张,相较于年龄相当的对照组KC小鼠,无菌群组表现出延迟的腺泡消除,胰腺功能减退,并且肿瘤内纤维化减少和胰腺重量下降。
而且在侵入式原位PDA模型中使用KPC衍生的肿瘤细胞的模型,给WT小鼠口服消除微生物群的抗生素治疗方案减少了约50%肿瘤影响。
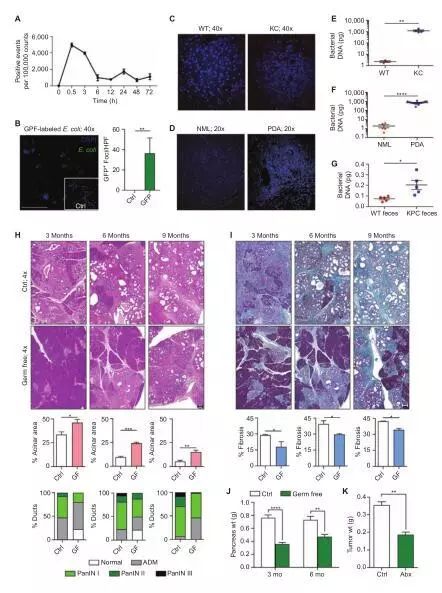
携带PDA患病宿主的微生物群导致
肿瘤发展和肿瘤内免疫抑制
与我们之前的结果一致,消除微生物对治疗肿瘤疾病有促进作用。此外,KPC衍生的排泄物会重新加快肿瘤生长,而再增殖来自年龄相当的WT小鼠的排泄物未能显著减少肿瘤的生长。我们也同时证实了肠道微生物迁移到胰腺与B. pseudolongum重新增殖有关。
分析肿瘤相关的巨噬细胞的表型(TAM),推测消除微生物导致还原免疫抑制且伴随着M1样的TAMs增加,从而表达更高的MHC II,CD86,TNF-α,IL-12和IL-6。
我们发现来自肠道微生物的无细胞提取物携带PDA的宿主减少了MHC II的表达,但相较于对照组小鼠,在脾巨噬细胞中却上调了IL-10。来自B. pseudolongum小鼠的无细胞提取物具有相似的作用减轻巨噬细胞的M1分化。
因为我们报告说巨噬细胞极化验证了我们假设,PDA中的T细胞免疫原性微生物消除会激活肿瘤浸润性T细胞。因此,抗微生物治疗会导致增强PDA中的免疫。此外,微生物消除增强了CD4 + T细胞的TH1极化以及CD4 + T细胞获得细胞毒性CD8 + T细胞表型,如上调T-BET,TNF-α,IFN-γ和CD38。
值得注意的是,使用抗生素后,来自KPC小鼠的排泄物的微生物的增殖逆转了与微生物相关的肿瘤内免疫原性。总的来说,这些数据表明微生物群体调节在PDA中的免疫原性。
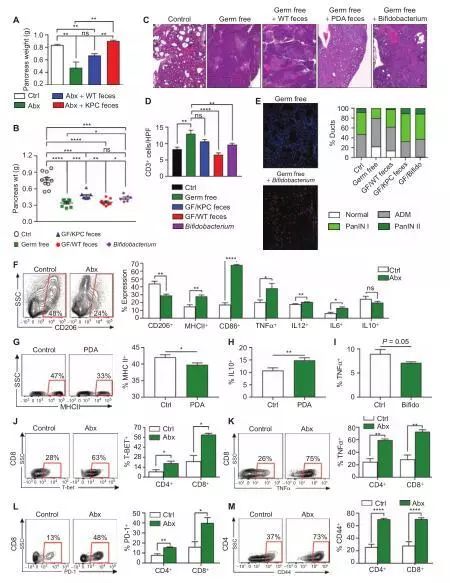
微生物群携带巨噬细胞介导
PDA中T细胞的免疫抑制
用来源于肠道微生物的无细胞提取物处理WT小鼠或KC小鼠的巨噬细胞。巨噬细胞携带来自肠道的PDA的宿主微生物,可减少免疫细胞的活化。相比之下,肠道微生物夹带的巨噬细胞的对照组,并未表现出抑制性状态。我们进一步推测是否由PDA微生物群携带的巨噬细胞在抗原呈递时是有缺陷的。
从抗生素诱导的PDA肿瘤中收集TAMs,相对于对照组小鼠,消除微生物的小鼠表现出增加活化T细胞的能力。将PDA浸润的T细胞从培养基中转移到对照小鼠,经抗生素治疗的PDA浸润小鼠的T细胞减少了肿瘤负担约50%。
此外,因为微生物消除上调了肿瘤内CD4 +的PD-1表达,我们假定微生物消除与PD-1指导具有协同效应疗法。尽管PD-1阻断不能保护对照小鼠免于原位PDA的作用,但基于肿瘤大小可以与微生物消除性口服抗生素进行协同作用,且与αPD-1进行联合治疗。
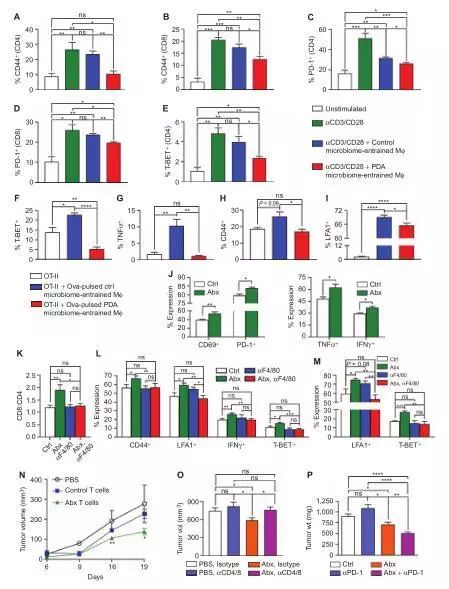
PDA微生物群通过TLR信号
传递TAMs促进免疫耐受
我们以前曾报道过多种PRR,包括TLR3,TLR4,TLR7,TLR9,NLRP3,Dectin-1和Mincle是在PDA中上调尿激酶,他们的激活可以加速肿瘤发生及诱导先天性和适应性免疫抑制。我们假设PRR活性的增高是通过PDA微生物群促进了免疫耐受。与我们的假设一致,在肿瘤微环境中,我们发现肠道微生物无细胞提取物来自于KC小鼠,可以诱导的多种不同的激活PRR的细胞系,与来自WT小鼠的肠道微生物提取物相比,作用最显著的PRR是TLR2,TLR4和TLR5。
通过流式细胞术发现TLR2和TLR5在PDA的巨噬细胞中发生上调,且对它们进行抑制会加速肿瘤生长并加剧先天和适应性免疫抑制。而抑制体内TLR的信号传导,可以通过阻止TRAF6消除PDA的促进效应。在抑制TLR的情况下,巨噬细胞携带PDA微生物群已经证明信号传导无法抑制T细胞免疫,进而说明PDA微生物群通过TLR信号传递TAMs诱导免疫耐受。
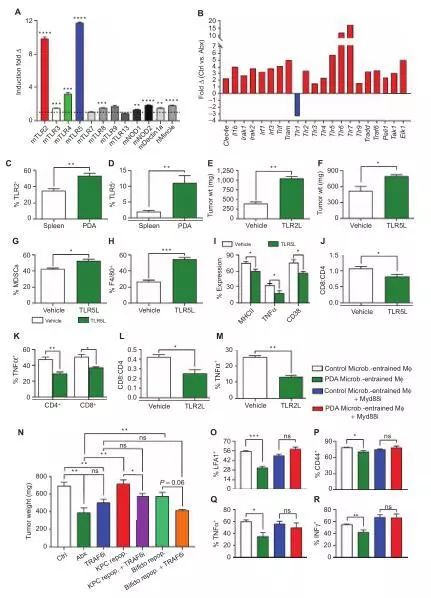
科研人员们发现与健康的胰腺相比,癌变的胰腺中含有明显而丰富的微生物群,与肠道中相比,这些在胰腺肿瘤中的微生物差异性增大,且消除这些微生物群可以避免侵入性和侵袭性的胰腺导管腺癌(PDA)。微生物消除与PDA肿瘤微环境的免疫原性重编程有关,包括还原髓系来源的抑制细胞和增加M1巨噬细胞分化,促进TH1分化的免疫细胞的激活。微生物消除也有助于通过上调PD-1表达来进行针对检查点的免疫治疗。在单核细胞中,PDA微生物群通过差异性激活选择性Toll样受体产生免疫耐受程序。这些数据表明,内源性微生物群会促使PDA特征的免疫抑制“瘫痪”,并认为微生物群在调节疾病进展的过程中具有治疗靶点的潜力。
通过胰腺导管进入胰腺的肠道微生物,导致胰腺中微生物过剩,而这些微生物诱导巨噬细胞,使免疫细胞无法被激活,从而导致免疫抑制,让癌细胞“明目张胆”的扩增起来。消灭肠道微生物,捍卫健康胰腺势在必行!
参考文献: Pushalkar S, Hundeyin M, Daley D, et al. The Pancreatic Cancer Microbiome Promotes Oncogenesis by Induction of Innate and Adaptive Immune Suppression[J]. Cancer discovery, 2018.[3]
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发