Science重磅!开扒肠道菌群与免疫系统不得不说的那些事!
| 导读 | 人类的肠道细菌可构成一个巨大而复杂的生态系统,而免疫系统是身体抵抗外来病原体的一道至关重要的防线。 |
近年来,随着不断深入的研究,越来越多的证据将机体的免疫系统与肠道菌群联系了起来,早有研究表明二者的影响是相互的,那么,专门“诛杀”微生物的免疫系统是如何同肠道有益菌和谐共处的呢?
近期,一项来自加州理工学院的新研究表明,某些特定种类的肠道有益菌可利用免疫系统的作用,在肠道中顺利安家落户,并且免疫应答还可以帮助这些有益菌繁殖,促进宿主肠道菌群的多样性。该研究成果以《Gut microbiota utilize immunoglobulin A for mucosal colonization》为题发表在5月3日的《Science》上。接下来我们就来看看肠道益生菌是如何与免疫系统“相爱不相杀”的吧!

益生菌繁荣的必要条件-有效空间位置
在有益菌群的选择上,研究人员将注意力放在了脆弱拟杆菌(Bacteroides fragilis,简写为B. fragilis) 上,这是一种哺乳动物大肠中常见的益生菌,有研究显示其可保护机体免受炎性肠病和多发性硬化症的影响。研究人员通过物理观察细菌所在的位置来确定B. fragilis与肠道的共生关系。
在小鼠肠道的电子显微镜显像结果中,研究人员发现B. fragilis大量聚集于肠道粘液厚层内的聚集体中,靠近肠道表面的上皮细胞,同时还发现完整的B. fragilis依偎在Lieberkühn隐窝的管道中,而这种空间位置是单个物种定居并建立稳定立足点所必需的。有了足够的有效空间,益生菌就能天天向上茁壮成长了!
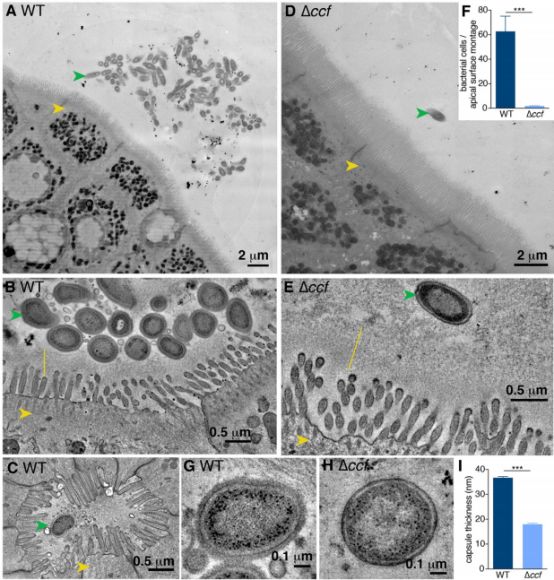
B. fragilis以CCF依赖的方式聚集于肠道粘液厚层内的聚集体中
益生菌的保护伞-多糖荚膜
研究人员在B. fragilis中鉴定了一个遗传基因座,称为共生殖菌因子(ccfABCDE;CCF),可通过调节B. fragilis荚膜中多糖的表达介导脆弱拟杆菌粘膜定殖和单一菌株稳定性。B. fragilis包裹在由CCF调节合成的多糖制成的厚荚膜中,这种荚膜可与免疫系统相互联系,从而保护自己免受免疫系统的攻击,而缺乏这种荚膜的突变细菌无法在粘膜层聚集。
因此,研究人员推测,CCF系统介导生成的多糖荚膜或许是B. fragilis菌株在肠道中独占其生态位的保障。这是B. fragilis独有的保护伞,来自免疫系统的攻击都被屏蔽了,自己就可以安心地繁殖了!当然其他益生菌也有自己的保护伞,主要成分也多为多糖荚膜。
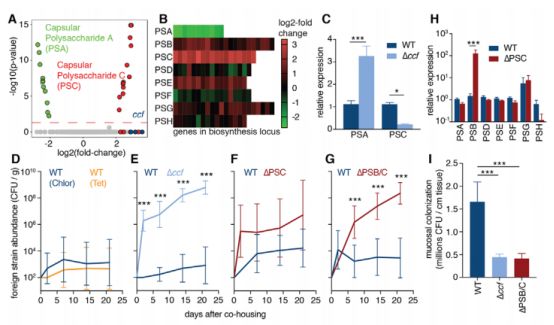
CCF系统介导生成的多糖荚膜对单一菌株稳定性的重要性
益生菌的好朋友-IgA
既然B. fragilis荚膜与免疫应答相关,那么是否存在针对B. fragilis荚膜的免疫应答呢?研究人员发现的确存在可与肠内的B. fragilis荚膜结合的抗体,就是免疫系统中常见的抗体-IgA。
通常情况下,抗体应答的出现意味着细菌的死亡。但研究人员发现了令人惊奇的现象,IgA对肠道中生存的大多数有益细菌并不会产生不利影响,甚至还可帮助B. fragilis粘附于肠道上皮。而在缺乏IgA的小鼠中,B. fragilis难以定居肠表面并保持长期稳定性。也就是说,这种对B. fragilis荚膜的IgA反应反而有助于将细菌锚定在上皮表面,有助于B. fragilis的生存和繁殖。过往的研究中,有人发现IgA还可增加大肠杆菌、乳双歧杆菌、乳杆菌对上皮细胞的粘附性,也就是说IgA可以帮助多种益生菌建立粘膜细菌群落。
但是必须要注意的是,疾病状态可能会诱发IgA对病原体和益生菌的免疫反应,从而破坏健康的微生物组平衡。也就是说,正常情况下IgA和B. fragilis相处愉快,还会提供帮助,一旦出现疾病,IgA还是会翻脸不认人的!
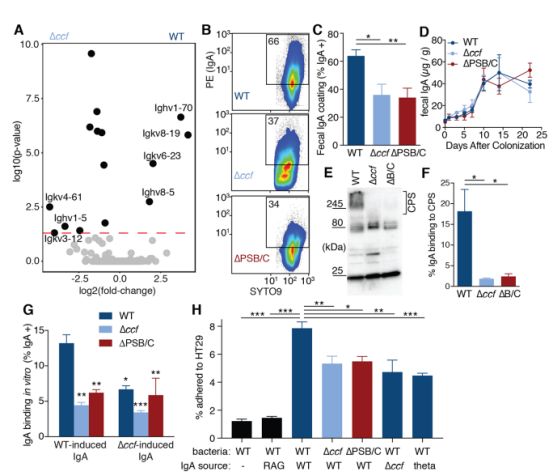
B. fragilis诱导特异性IgA应答,依赖于CCF调节表面荚膜多糖,增强上皮粘附

IgA对B. fragilis定植的重要性
目前,我们尚不清楚肠道菌群是如何建立和维持长期肠道定植,免疫系统是如何识别肠道菌群和病原体也尚未知晓。但该研究有助于找寻纠正微生物组失衡的新方法,在预防和治疗各种人类疾病方面有重要意义。
参考文献:
Gut microbiota utilize immunoglobulin A for mucosal colonization
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发