人体免疫细胞竟然促进肿瘤扩散?!《Nature》子刊解密巨噬细胞促癌作用!
| 导读 | 巨噬细胞竟占肿瘤中总重量的50%。这些肿瘤相关巨噬细胞不仅会阻止T细胞攻击肿瘤细胞,而且还会分泌生长因子滋养肿瘤细胞,促进肿瘤血管的生成,导致肿瘤细胞转移扩散。 |
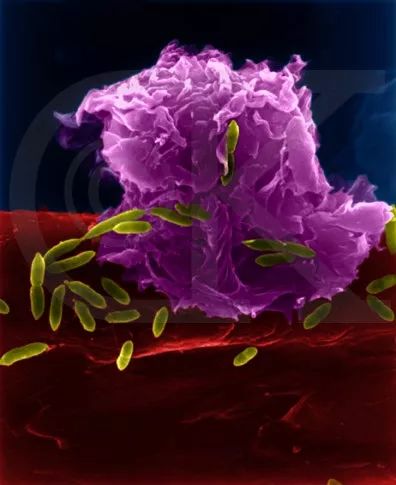
近年来的研究发现,巨噬细胞竟占肿瘤中总重量的50%。这些肿瘤相关巨噬细胞(Tumor-associated macrophage, TAM)不仅会阻止T细胞攻击肿瘤细胞,而且还会分泌生长因子滋养肿瘤细胞,促进肿瘤血管的生成,导致肿瘤细胞转移扩散。然而有趣的是《自然》出版社旗下的《biomedical engineering》发表了一项的研究指出:合理设计的药物纳米颗粒组合能够有效调节TAMs进行癌症免疫治疗。

免疫治疗是一种新兴疗法,深受癌症届的欢迎,然而之前就有报道指出由于巨噬细胞的“捣蛋”导致肿瘤免疫治疗对部分患者无效。斯坦福大学的研究人员进一步作了相关报道:一味地消除肿瘤相关巨噬细胞会招募一类有着强大免疫抑制活性的细胞累积,这对免疫系统造成了巨大的攻击力。近来哈佛医学院系统生物学中心的Christopher B. Rodell教授等人在此方面有了颠覆性的进展。
肿瘤相关巨噬细胞
TAM相当具有可塑性,研究人员起初假定它可以表现出两种不同的表型和功能,既可以是肿瘤支持性(M2样细胞)也可以是杀肿瘤性(M1样细胞)。之前的研究中都是以耗竭M2样细胞为治疗策略,结果并不可观。而另一种策略引起了Christopher B. Rodell教授等人极大地兴趣,即将表型转换(再教育)为杀肿瘤M1样细胞。他们利用小分子抑制受体、酪氨酸激酶或其他转导TAM的通路来进行研究,但同样遇到了障碍,如:哪些小分子能最有效地影响M2→M1表型的转化?在体内优先将小分子递送至TAM的能力不足以及会导致次优疗效。
为了应对这些挑战,研究者们着手开发高通量和低成本的表型筛选实验,以直接比较不同小分子将M2样巨噬细胞转化为为M1样细胞的效率。他们还假设从纳米治疗制剂中包裹出来的药物可以在体内更有效地递送到TAM,因为纳米颗粒通常被巨噬细胞快速内化。使用这种方法的系统性治疗在手术治疗中无法进入的肿瘤中特别有用,其中肿瘤内注射是不可行的。因此他们进一步假设共价交联CD将能够形成具有巨噬细胞亲和力和高载药量的环糊精纳米颗粒(CDNPs)。接下来的实验结果也表明了这个新策略的可行性及与进展的顺利性。实验中运用不同的小鼠和肿瘤模型可以直接观察TAM亚群体内,利用巨噬细胞对载药纳米粒子的亲和力可以实现有效的TAM递送、优先改变骨髓表型、通过与检查点治疗合作改善免疫疗法反应,这导致了显着的抗癌功效。
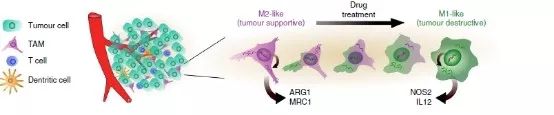
M2样肿瘤细胞向M1样肿瘤细胞转化的机制
TAM靶向治疗主要试图缩减TAM患者。例如,已经开发了几种小分子和抗体药物来拮抗CC趋化因子受体2型(CCR2)或集落刺激因子-1受体(CSF1R,也称为MCSF-R)信号,它们可以延迟动物研究中的肿瘤进展,如果一切顺利,它有望迈入人体实验,评估其在人体内的应用潜力。
然而,实验研究也表明,TAM耗竭可能不足以引发持久的抗癌反应。另一种治疗策略是重新培养这些细胞。再教育策略不仅提供了消除吞噬细胞的肿瘤支持功能的可能性,而且还积极促进其抗肿瘤免疫作用,因此其与免疫检查点阻断疗法联合时可以更有效。尽管如此,TAM再教育疗法的发展仍然存在重大挑战。
参考文献
ChristopherB. Rodell1, Sean P. Arlauckas 1, TLR7/8-agonist-loadednanoparticles promote the polarization of tumour-associated macrophages to enhance cancer immunotherapy
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发