神经系统疾病治疗的下一个前沿——ASOs
| 导读 | 从人们首次发现反义寡核苷酸(Antisense oligonucleotides, ASOs)具有干扰mRNA和调节蛋白质表达的性能,到最近FDA批准一款治疗脊髓性肌萎缩的ASOs药物,这期间经历了近40年的漫长积淀。 |
从人们首次发现反义寡核苷酸(Antisense oligonucleotides, ASOs)具有干扰mRNA和调节蛋白质表达的性能,到最近FDA批准一款治疗脊髓性肌萎缩的ASOs药物,这期间经历了近40年的漫长积淀。
在早期研究阶段,ASOs存在靶向性不强、生物活性不足、脱靶毒副作用等诸多短板,而今,一些经化学修饰ASOs的出现很好地解决了上述问题,随着对ASOs作用机制的深入研究,以及大规模更具针对性临床试验的开展,制药行业逐渐掀起一股ASOs研发热。
目前,很多神经系统疾病缺乏有效的药物干预手段,这些疾病是ASOs治疗策略的理想实践平台。近几年,用于治疗杜氏肌营养不良、脊髓性肌萎缩的ASOs药物先后获FDA批准上市,可以看作ASOs在这一领域“里程碑式”的开拓。
化 学 修 饰
反义寡核苷酸是指与靶基因mRNA互补的一段单链DNA或RNA序列,通常由十几到几十个碱基组成,通过化学合成的方式生产。不经修饰的ASOs不论在体液内还是细胞中都极易被降解,不能发挥其反义作用。而经化学修饰的ASOs,显著提高了其成药性。目前ASOs基本骨架常见的几种化学修饰方式如图1所示。
其中硫代寡核苷酸(phosphorothioate)、混合骨架寡核苷酸(mixed backbone oligonucleic acid)和多肽核酸(peptide nucleic acid)应用广泛,成为具有代表性的第一、二、三代ASOs。

图1 ASO基本骨架常见的几种化学修饰方式
由于磷酸二酯键是核酶的主要靶点,因此采用硫化试剂将ASO磷酸二酯键硫化,形成硫代寡核苷酸,是增强ASO稳定性的有效途径。硫代寡核苷酸是迄今研究最深入、应用最广泛的结构。作为第一代ASO,硫代寡核苷酸具有良好的水溶性、稳定性及易于大量合成,半衰期也更长,基本能满足临床治疗的需要。核糖取代物,包括2'-甲基(2'-OMe),2'-甲氧基乙基(2'-MOE)和锁定的核酸(locked nucleic acid),经常被用于进一步增加稳定性、靶向性,并且通常具有更少的毒性。
混合骨架寡核苷酸是人们根据不同修饰的ASO特性而加以各种组合设计而成。与硫代寡核苷酸相比,混合骨架寡核苷酸通过不同化学修饰的组合降低了硫代磷酸二酯键的数量,减少了自身携带的负电荷,降低了体内降解速度并改变了核酸降解物的种类,从而减少了由硫代导致的副反应。比如,phosphorodiamidate morpholino (PMO),其中脱氧核糖骨架被一个吗啡环取代,而带电的磷酸二酯间链则被一个无电荷的磷胺基链取代。
多肽核酸(PNA)是以2-氨基乙基甘氨酸为基本单元,碱基通过一个甲基羰基与类肽链骨架相连。体外试验证明,PNA与RNA结合可抑制逆转录过程,与双链DNA发生链侵入反应后,可有效阻断限制性内切酶对酶切位点的识别和切割,从而阻断蛋白的表达。与前两代ASO相比,PNA具有更强的亲和力及更好的特异性,往往更短的片段即可获得相同的反义效果;具有良好的蛋白酶和核酸酶抗性,在细胞培养液及体内不易降解,半衰期更长;经修饰后具有良好的细胞膜穿透性,其应用前景广阔。
药 效 机 理
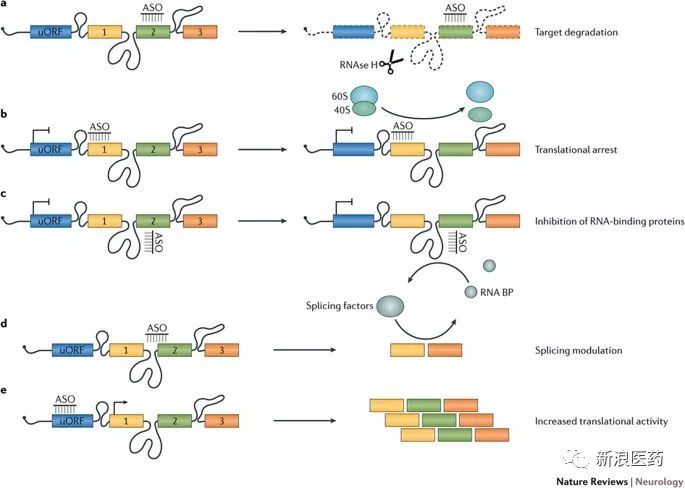
图2 ASOs作用机制
对反义寡核酸进行某些特定而合适的化学修饰后,其通过一定方式进入细胞,能够特异性地调控靶基因的表达。其作用机制是:1. 反义寡核苷酸与靶mRNA结合形成DNA- RNA杂合分子,可以激活RNase H,该酶可以切割杂合分子中的RNA链,导致靶mRNA降解。2. 不能激活RNase H活性的反义寡核苷酸可以通过空间位阻效应阻止核糖体结合来抑制靶mRNA的翻译;另外还可以通过封闭剪接位点有选择的促进蛋白某个可变剪接体的表达,从而纠正错误的剪接。如图2所示。
临 床 试 验
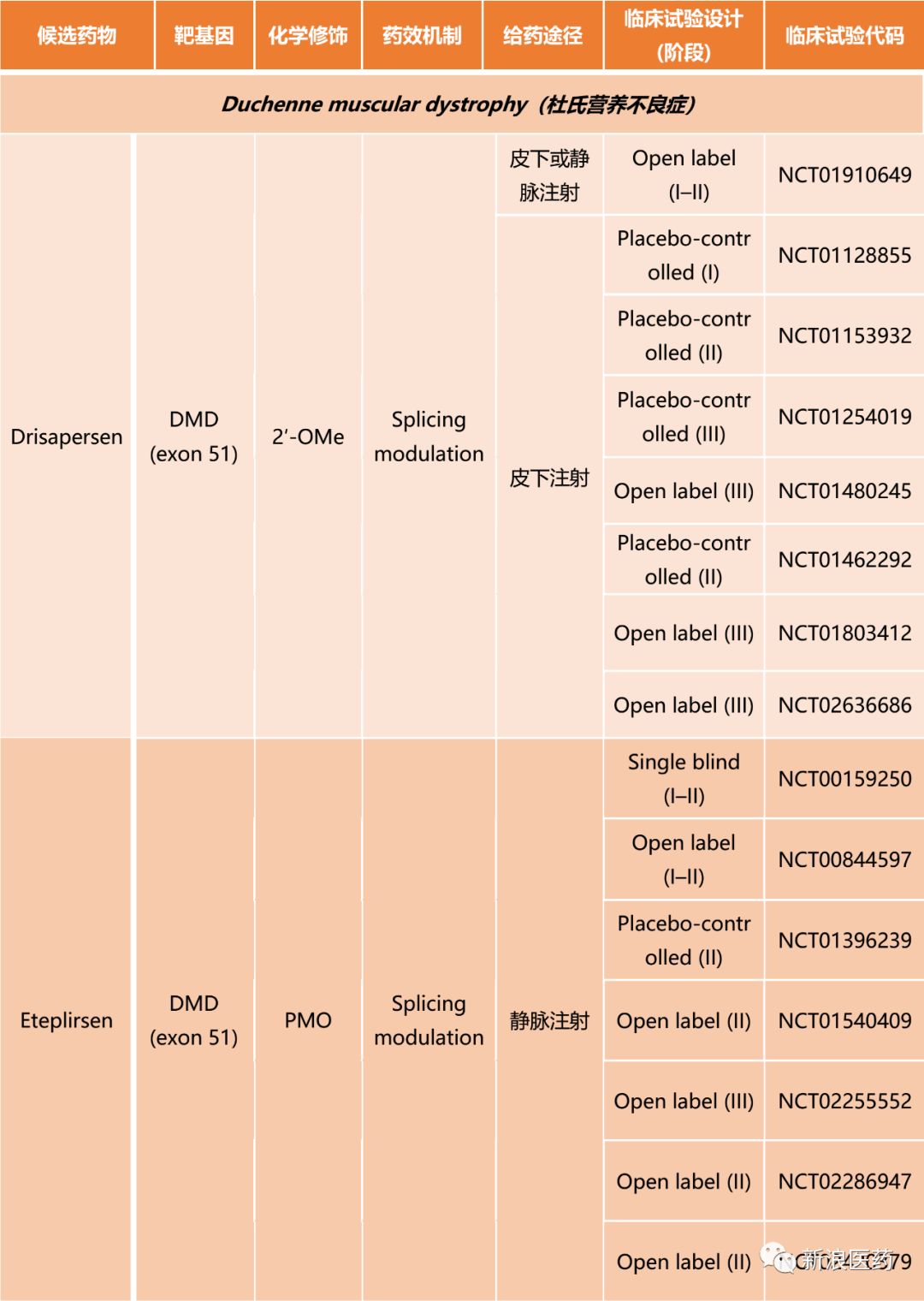
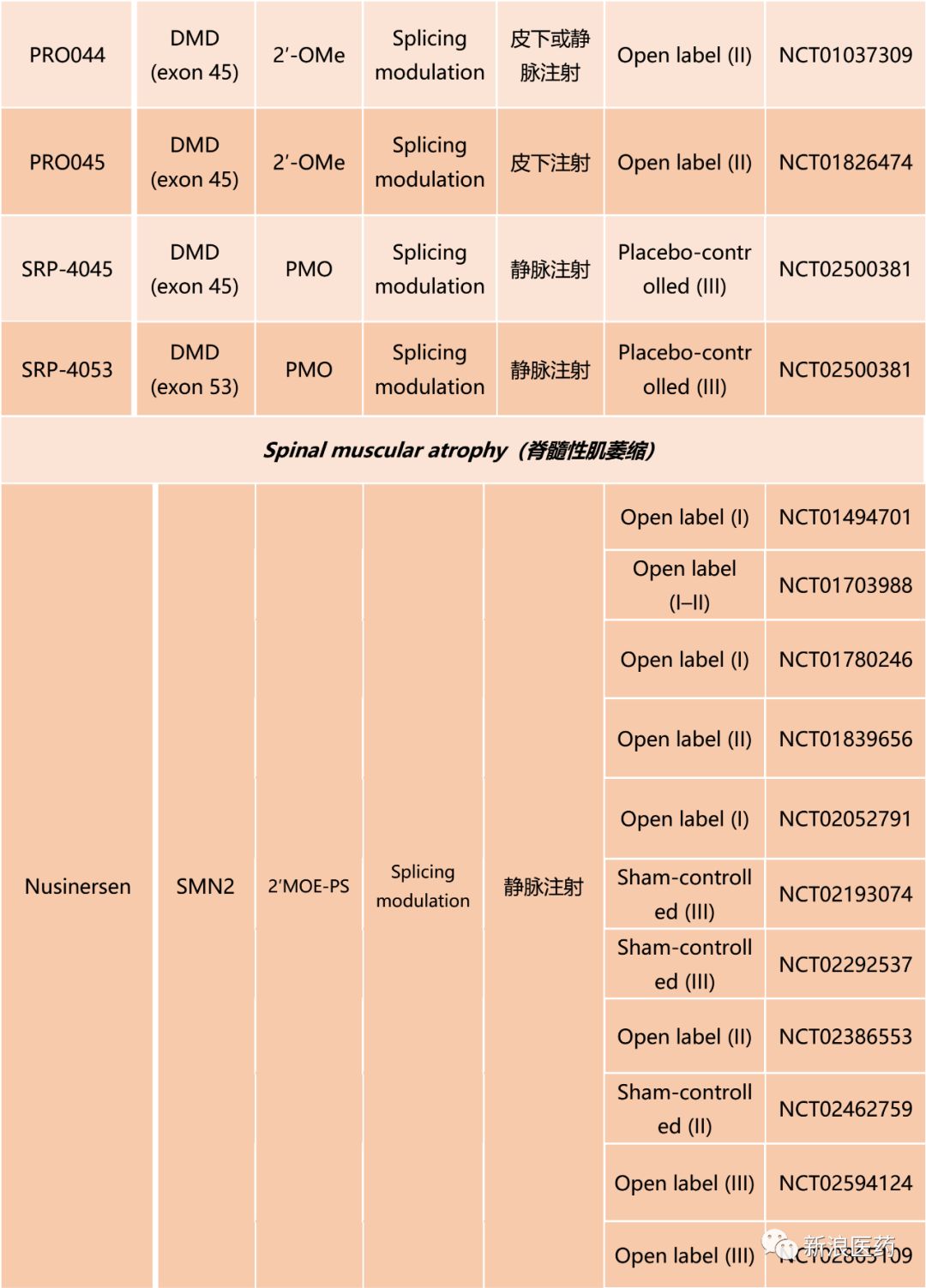
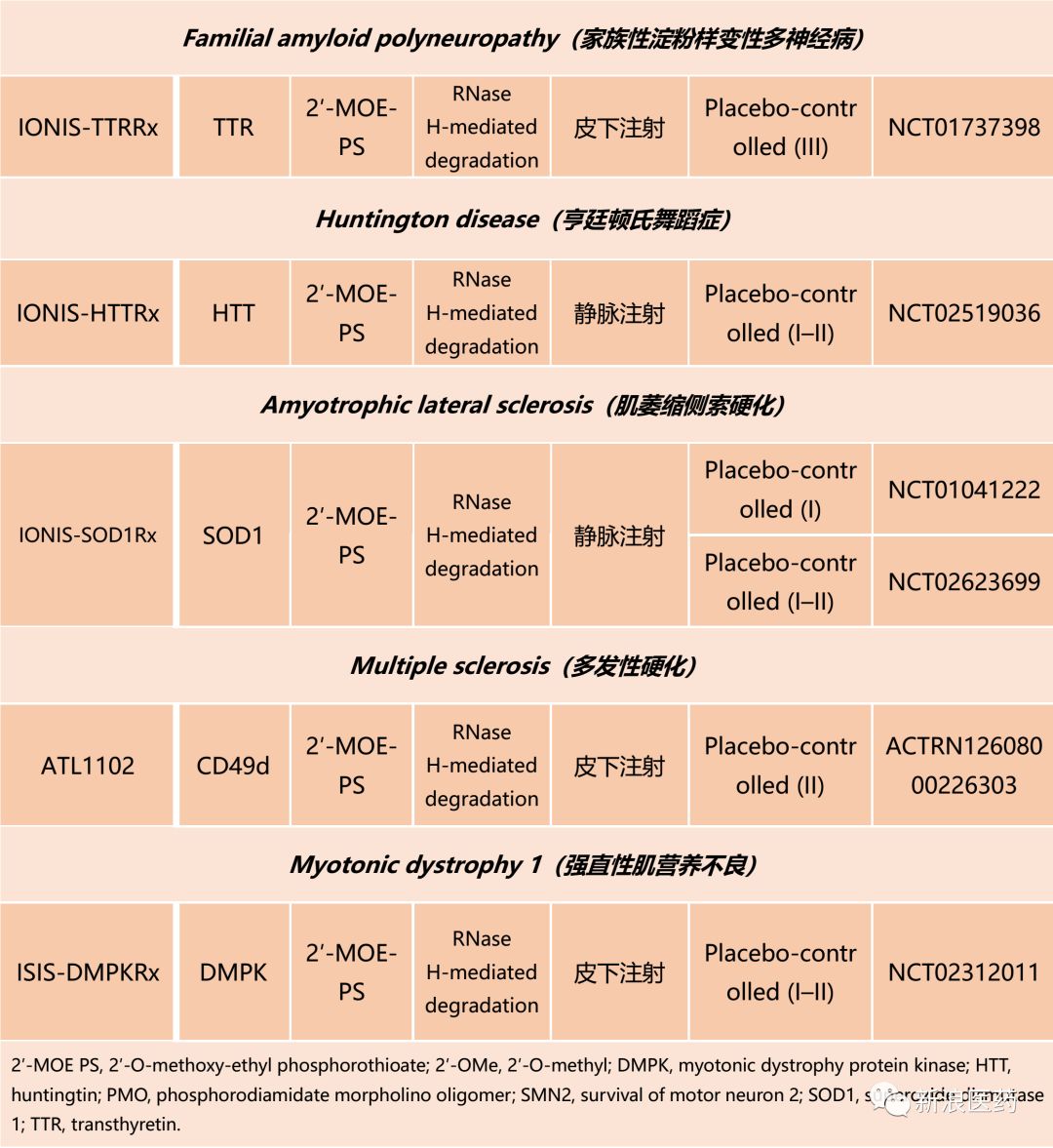
自1970s以来,ASOs的治疗作用就被寄予厚望,但经过几十年的成药性研究,ASOs才得以进入临床试验阶段。当前ASOs在神经系统疾病开展的临床试验如表1所示。
杜氏营养不良症的治疗研究主要借助于ASOs的剪接调节(Splicing modulation)作用;采用皮下或静脉注射的给药方式;靶向基因主要集中在DMD (exon 45)、DMD (exon 51)、DMD (exon 53);ASO普遍采用2′-OMe、PMO等化学修饰手段;临床试验主要集中在II、III阶段。
脊髓性肌萎缩、家族性淀粉样变性多神经病、亨廷顿氏舞蹈症、肌萎缩侧索硬化、多发性硬化、强直性肌营养不良等的治疗研究主要借助于ASOs的RNase H调节降解(RNase H-mediated degradation)作用;采用皮下或静脉注射的给药方式;靶向基因分别为SMN2、TTR、HTT、SOD1、CD49d、DMPK;ASO普遍采用2′MOE-PS化学修饰手段;临床试验主要集中在I、II阶段。其中,在2016年12月被FDA批准用于治疗SMA的nusinersen,代表了一个典型的临床研究案例。
表1 ASOs针对神经系统疾病的临床试验
结 语
随着分子化学技术的发展,ASOs的分子结构将更加优化,从而提高反义分子被细胞摄取的速率及程度,提高靶向性,稳定性,降低毒性。近来,治疗DMD的eteplirsen和治疗SMA的nusinersen分别获批上市,为ASOs应用于病理机制清晰的神经系统疾病奠定了基础。随着越来越多临床试验的开展,ASOs疗法或许会重塑很多神经系统疾病的治疗前景。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发