【2018年度盘点】快来看!今年FDA发布了哪些癌症重磅政策!
| 导读 | 2018年余额仅剩4天这一年里FDA发布了多项重磅政策不过大家最关心的不外乎癌症领域转化医学网年终特别策划盘点2018FDA发布的十大癌症领域重磅政策2018FDA政策盘点2月17日FDA批准特定肺癌首款新疗法 |
2018年余额仅剩4天
这一年里FDA发布了多项重磅政策
不过大家最关心的不外乎癌症领域
转化医学网年终特别策划
盘点2018FDA发布的十大癌症领域重磅政策

FDA批准特定肺癌首款新疗法
2月17日,FDA宣布批准阿斯利康(AstraZeneca)的肿瘤免疫疗法Imfinzi(durvalumab),用于罹患III期非小细胞肺癌(NSCLC),且肿瘤无法通过手术切除、但病情在现有放化疗的治疗下没有出现进展的患者。这是美国FDA针对这一患者群体批准的首款用于减少癌症进展风险的疗法。
FDA批准十年来首款肝癌系统疗法
8月17日,FDA宣布批准卫材(Eisai)公司研发的lenvatinib作为治疗无法切除的肝细胞癌(hepatocellular carcinoma,HCC)的一线疗法。这是在获得批准治疗甲状腺癌和肾癌之后,lenvatinib添加的最新适应症。
FDA批准辉瑞新药一线治疗EGFR突变肺癌
9月28日,辉瑞公司(Pfizer)公司宣布,美国FDA批准该公司的Vizimpro(dacomitinib)作为一线疗法,治疗携带EGFR基因外显子19缺失或外显子21 L858R置换突变的转移性非小细胞肺癌(NSCLC)患者。这些患者肿瘤中携带的突变都已通过FDA批准的诊断测试得到确认。
FDA批准第三款PD-1抑制剂
9月29日,FDA宣布批准赛诺菲(Sanofi)和再生元(Regeneron)联合开发的Libtayo(cemiplimab-rwlc)上市,用于治疗转移性皮肤鳞状细胞癌(CSCC)或不能接受治愈性手术或放疗的局部晚期CSCC患者。这是FDA批准的第一例针对晚期CSCC的疗法。它同时是第三款获得FDA批准的抗PD-1抗体。
FDA批准辉瑞新药治疗乳腺癌
10月17日,FDA宣布,批准辉瑞(Pfizer)公司的抗癌新药Talzenna(talazoparib)上市,用以治疗携带生殖系BRCA突变(有害或怀疑有害),HER2阴性的局部晚期或转移性乳腺癌患者。Talazoparib是辉瑞公司研发的PARP抑制剂。这是迄今为止FDA批准的第4款PARP抑制剂。
FDA加速批准辉瑞第三代ALK抑制剂上市,治疗非小细胞肺癌
11月3日,辉瑞公司宣布,美国FDA批准该公司研发的第三代ALK酪氨酸激酶抑制剂(TKI)Lorbrena(lorlatinib)上市,用于治疗ALK阳性转移性非小细胞肺癌(NSCLC)患者。这些患者在接受crizotinib或者至少一种其它ALK抑制剂治疗后疾病继续恶化,或者接受alectinib或ceritinib作为第一种ALK抑制剂疗法后疾病继续恶化。
治疗复发性晚期肝癌,FDA今日扩展Keytruda适应症
11月10日,美国FDA加速批准默沙东(MSD)的重磅癌症免疫疗法Keytruda(pembrolizumab)用于治疗已经接受过sorafenib治疗的晚期肝细胞癌(HCC)患者。
2个月里第4款抗癌新药!辉瑞白血病新疗法今日获批
11月22日,FDA宣布批准辉瑞(Pfizer)公司开发的Daurismo(glasdegib)上市,与低剂量阿糖胞苷(LDAC)化疗联用,治疗新确诊的75岁以上,或因慢性健康问题和疾病无法使用高强度化疗(intensive chemotherapy)的急性骨髓性白血病(AML)患者。
FDA加速批准不限癌种靶向疗法,治疗NTRK融合肿瘤
11月27日,FDA加速批准Loxo Oncology和拜耳(Bayer)共同开发的Vitrakvi(larotrectinib)上市,用于治疗携带NTRK基因融合的成年和儿童局部晚期或转移性实体瘤患者,不需考虑癌症的发生区域。这一药物的批准,是癌症疗法从“基于癌症在体内的起源”转向“基于肿瘤的遗传特征”这一演变过程中的重要里程碑。
FDA批准新药治疗白血病
11月29日,FDA宣布,批准安斯泰来(Astellas Pharma)公司的Xospata(gilteritinib)上市,用于治疗携带FLT3基因突变的复发/难治性急性骨髓性白血病(AML)成人患者(约占患者总数的三分之一)。这些患者的基因突变需要被FDA批准的伴随诊断确认。
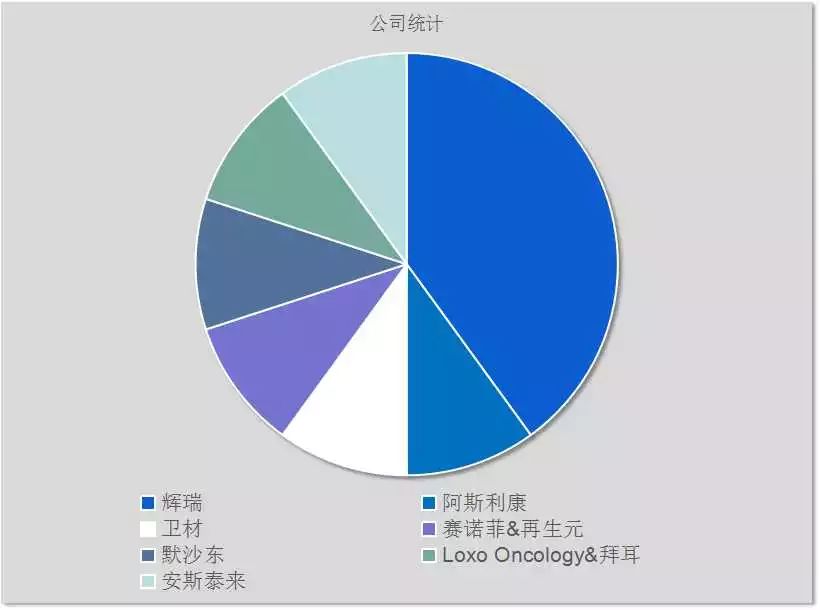
由以上可以看出
辉瑞公司荣膺2018FDA新药审批的年度冠军
癌症领域独占四席
新的一年
又会有哪些公司上榜呢
让我们拭目以待
✬如果你喜欢这篇文章,欢迎分享到朋友圈✬
评论功能现已开启,我们接受一切形式的吐槽和赞美☺
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发