肿瘤免疫治疗的风向标——生物标志物大盘点
| 导读 | 导读近年来,肿瘤免疫治疗取得了令人瞩目的成果,诸多临床研究已证实肿瘤免疫治疗可改善肿瘤患者的预后,显著延长患者的生存期... |
近年来,肿瘤免疫治疗取得了令人瞩目的成果,诸多临床研究已证实肿瘤免疫治疗可改善肿瘤患者的预后,显著延长患者的生存期。与此同时,肿瘤免疫治疗生物标志物的探索也成为了肿瘤免疫治疗研究的热点。
2018年12月16日召开的2018 CSCO肿瘤免疫治疗年会暨第二届广州国际肿瘤免疫治疗论坛上,来自上海同济大学附属肺科医院肿瘤科的苏春霞教授对肿瘤免疫治疗的生物标志物进行了盘点,医脉通根据苏教授的报告整理如下。
生物标志物可以协助判断预测治疗的有效性,也承担着指导临床药物使用的“重要角色”。目前用于预测免疫检查点抑制剂疗效的标志物主要有以下几种:
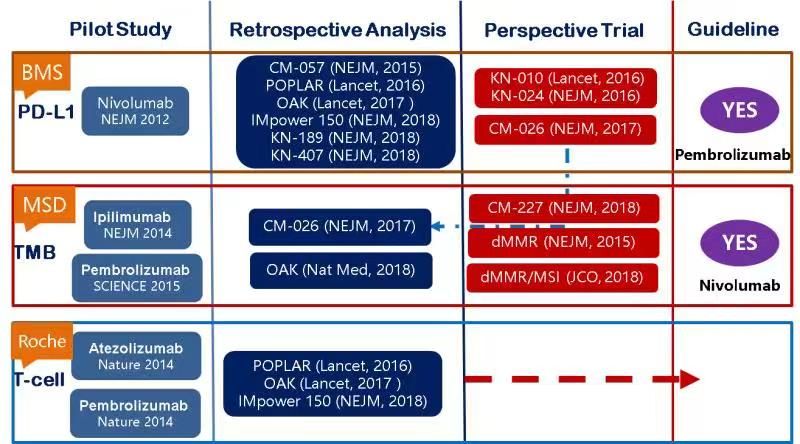
PD-L1
随着pembro、nivo、atezo等一系列研究结果的陆续公布,免疫治疗获得FDA批准和NCCN指南推荐,成为晚期非小细胞肺癌(NSCLC)一线治疗的选择,而PD-L1表达也成为了NSCLC患者接受免疫治疗简单可行的筛选优势人群的生物标志物。
多项研究显示,无论是免疫单药还是免疫联合一线治疗,PD-1/PD-L1抑制剂疗效与PD-L1表达水平密切相关。
然而,由于PD-L1的生物学特性,使得PD-L1 作为生物标志物也面临一定的挑战。比如肿瘤具有异质性,同一个病灶的不同位置,不同病灶之间的PD-L1表达是不同的,那么究竟该信赖哪一个?另外,PD-L1的表达是诱导性的、动态表达,也就是说在治疗的不同阶段,不同的治疗方式是会影响PD-L1的表达的。不同平台间检测PD-L1表达水平的一致性不佳,检测方法也尚存较大争议。

因此,PD-L1的表达给不了一个绝对的可以用免疫药物且效果好,或者不能用免疫药物的判断。这也决定了PD-L1不是一种完美的预测免疫治疗的生物标志物,但是可以参考。
肿瘤突变负荷(TMB)
TMB是指肿瘤基因组中去除胚系突变后的体细胞突变数量。肿瘤TMB越高,则肿瘤产生的新抗原越多,T细胞反应和抗肿瘤反应越强。其中,在黑色素瘤、肺癌、膀胱癌和胃肠道肿瘤中,TMB表达最高。
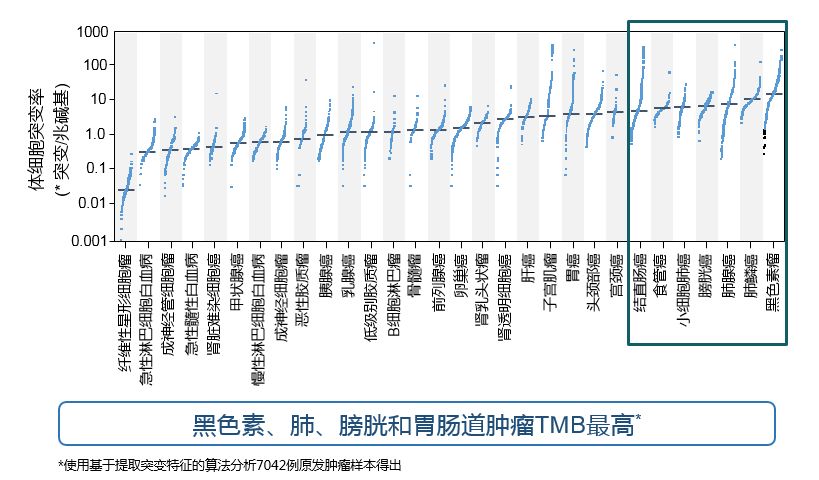
2017年Nat Rev Cancer发表的回顾性数据表明,PD-1/PD-L1抑制剂在各瘤种的疗效均与TMB成正相关。N Engl J Med发表的研究显示,在接受PD-1或PD-L1抑制剂治疗的27个瘤种肿瘤患者中,各瘤种ORR均与TMB水平呈正相关,TMB表达水平越高,PD-1/PD-L1抑制剂的治疗效果越好。
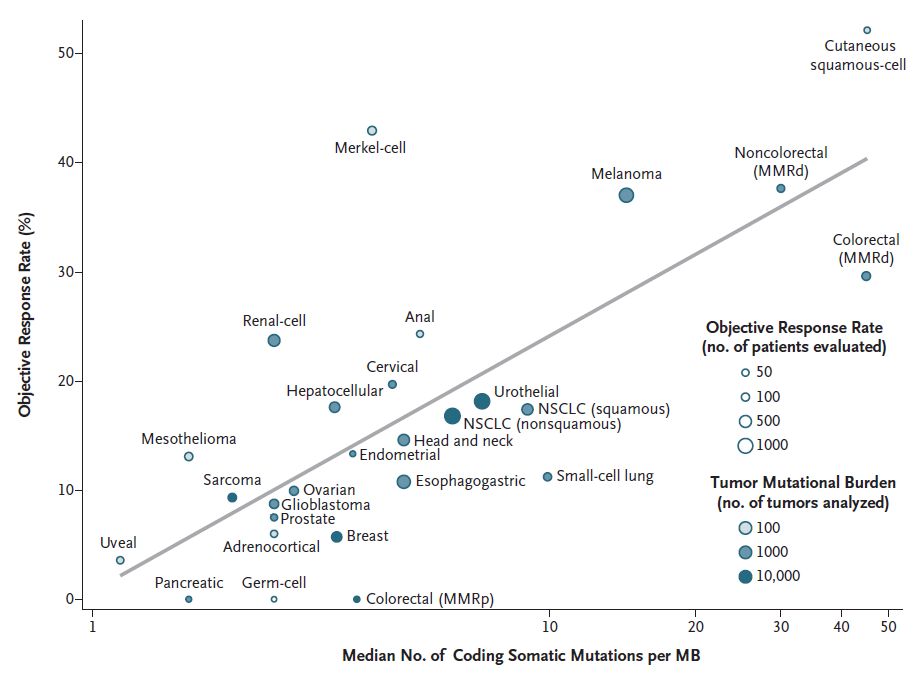
另外,来自临床研究的生物标志物分析显示,高TMB与I-O治疗应答强烈相关,高TMB是I-O治疗应答的生物标志物。
CheckMate 026研究显示,高TMB组,纳武利尤单抗(Nivolumab)的ORR较化疗明显提高(47%对比28%)且PFS明显延长(9.7个月对比5.8个月)。CheckMate 568研究显示,高TMB患者的ORR升高。
CheckMate 227研究探索了TMB作为疗效预测标志物的PFS结果,也探索了PD-L1分层的OS结果。结果显示,纳武利尤单抗联合伊匹单抗治疗高TMB患者的PFS显著优于化疗,1年PFS率分别为43%和13%,中位PFS分别为7.2和5.4个月(HR=0.58,P=0.0002)。在高TMB人群中,无论PD-L1表达与否,免疫联合免疫治疗PFS均优于化疗。
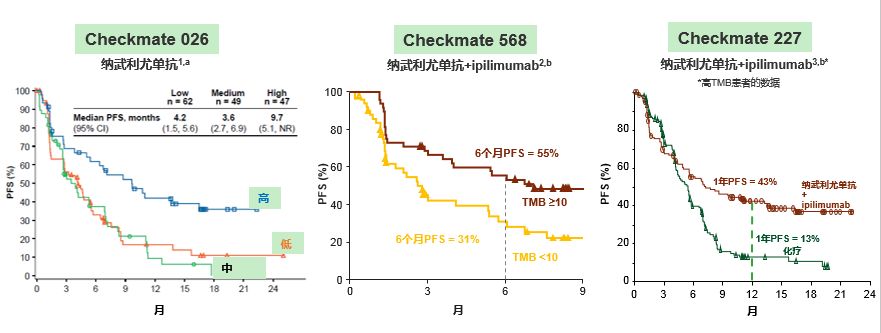
继PD-L1之后,TMB逐步成为预测免疫检查点治疗疗效的潜在标志物。作为一种更广谱的免疫治疗,已从临床研究热点正走向临床应用。但TMB作为预测标志物还有很多问题,如TMB的检测由于依赖基因测序,目前成本还是要高于PD-L1检测;不同平台的检测标准不统一;标本存放时间对TMB的结果判断也会有一定影响等。随着NGS panel的获批,TMB检测也将慢慢走近临床实践。在具体的临床实践中,如果组织的样本量不够,是否可以使用ctDNA来检测TMB也是未来临床检测TMB状态需要考虑的问题。
同时,TMB & PD-L1是I-O治疗应答的独立标志物,CheckMate 012, 026和227 (NSCLC)研究的分析结果显示,TMB和PD-L1表达无相关性。atezolizumab(NSCLC和UC)研究的数据同样证实,TMB和PD-L1表达无相关性或相关性弱。
错配修复缺陷/高微卫星不稳定
(dMMR/MSI-H)
微卫星高度不稳定(MSI-H)和错配修复功能缺陷(dMMR)代表两种不同检测方法所产生的结果,但它们代表的临床指导意义非常类似, MSI-H可以被认为是等同为dMMR。如果患者的肿瘤组织病灶检测为MSI-H,或者dMMR,则意味着体细胞过度突变,肿瘤表达出很多新抗原,这使得肿瘤很容易被免疫系统所识别,进而激活发挥杀伤功能的机会。
在结直肠癌患者中,大约10%的患者是MSH-H或dMMR的病人。在CheckMate-142研究的nivolumab单药队列中,nivolumab显示出较好的疗效。在经治疗的mCRC患者中,nivolumab的持续的疾病控制率DCR(>=12周)为69%;9个月和12个月的PFS率分别为54%和50%;9个月和12个月的OS率分别为78%和73%。基于这些研究数据,nivolumab已被FDA获批用于标准化疗进展后的dMMR/MSI-H型mCRC患者。
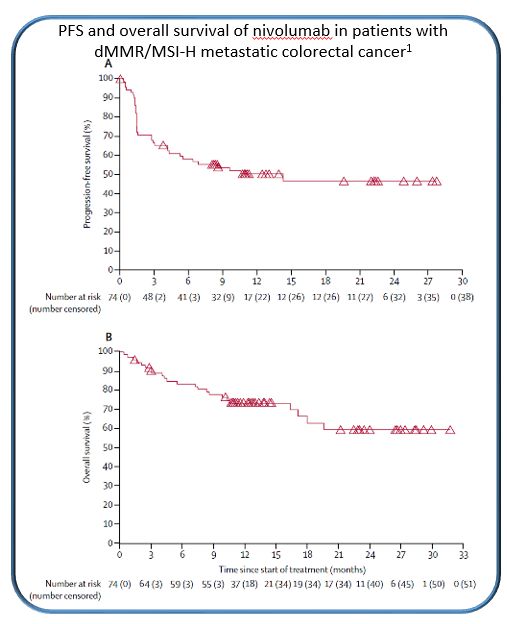
TMB & MSI是I-O治疗应答的重叠标志物,MSI是遗传不稳定性的标志物,因此,伴有不稳定基因组的肿瘤可同时表现为微卫星不稳定性高(MSI-高)和高TMB。对38个肿瘤类型62,150个样本的分析结果显示,MSI-高是高TMB(≥20 mut/Mb)的子集。大多数MSI-高的样本同时表现为高TMB(83%),然而,仅16%的高TMB样本表现为MSI-高。这两种表型同时出现与肿瘤类型高度相关,高TMB和MSI-高同时出现在胃肠道肿瘤中,但是在伴高TMB的黑色素瘤、肺癌和鳞状细胞癌中,MSI-高并不常见。
炎性肿瘤(TILs/GEP)
肿瘤的炎性状态为biomarker探索带来启示。已有相关报道,免疫治疗的效果和肿瘤是否被免疫细胞浸润有关,若是肿瘤中无肿瘤浸润T细胞,PD-1抑制剂将毫无用武之地。所以,肿瘤组织中有丰富的T细胞,那它对免疫疗法的响应较高。T细胞炎性基因表达谱GEP可作为T细胞炎性肿瘤微环境(TME)的炎性Biomarker。
PD-L1和GEP都是指示TME的炎性生物标志物,而TMB和MSI-H是由体细胞肿瘤突变产生的肿瘤抗原性的间接评价指标。然而,这两类生物标志物之间的关系尚未得到很好的描述。
在一项新的研究中,研究人员在来自四项KEYNOTE临床试验的300多例患有22种肿瘤类型的晚期实体瘤和黑色素瘤的患者样本中,评估了利用TMB和 GEP联合预测对帕博利珠单抗作出临床反应的潜力。
结果显示,TMB和GEP仅表现出适度的相关性,并且独立地预测这些KEYNOTE临床试验数据集中的患者临床反应。在TCGA数据库中,GEP和TMB同样具有较低的相关性,这就证实了在不同癌症类型中联合使用GEP和TMB对转录组特征和基因组特征进行分类的潜力。
液体活检生物标志物探索
利用ctDNA检测bTMB水平
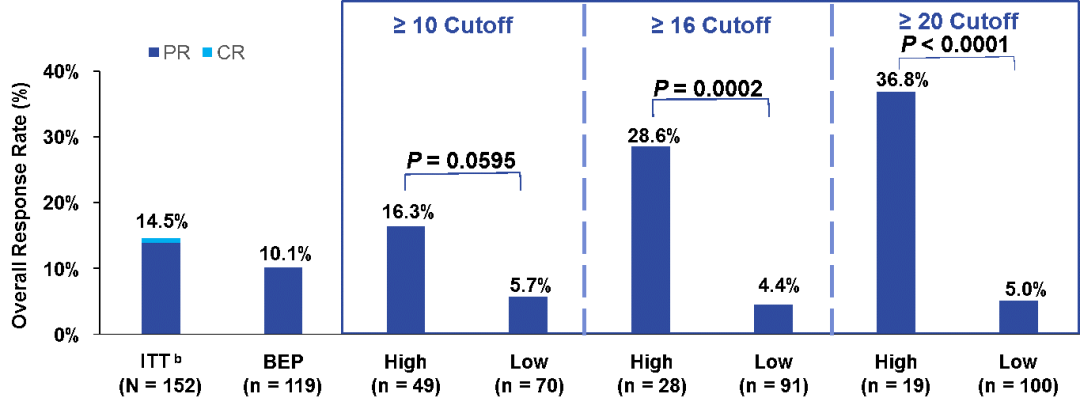
在2018 ESMO大会上重磅发布了B-F1RST研究。B-F1RST研究是第一项前瞻性评估bTMB作为atezolizumab疗效预测标志物的研究。与中期分析结果一致,以既定的bTMB≥16作为cut-off值,高bTMB组的ORR显著更高、PFS和OS在数值上也观察到更好的趋势。这一结果进一步支持了正在进行的III期研究BFAST以bTMB作为标志物来筛选入组人群。
利用CTC实现PD-L1表达水平的动态监测
近年来,作为液体活检的开路先锋和主要成员,如何检测CTC的分子特征从而反映肿瘤的分子特征,这是大家一直以来关注的问题,也关系到CTC能否在临床上具有越来越大的应用价值。
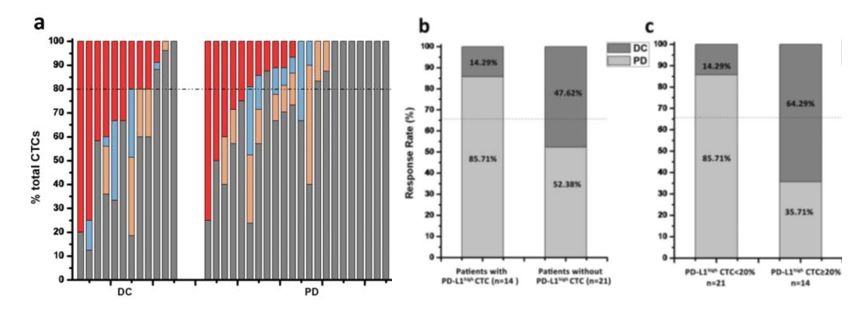
今年3月份发表在《Oncoimmunology》上的一项研究招募了36名接受PD-1单抗IBI308治疗的晚期消化道肿瘤患者,使用“肿瘤捕手”技术对患者用药前、后分别进行CTC检测,结果发现外周血中有PD-L1高表达CTCs的患者更容易从PD-1药物中获益,而且这类细胞比例越高,响应率越高。研究者表示,PD-L1高表达(PD-L1high)的CTCs的比例可用于预测PD-1单药治疗效果。
外泌体中特定蛋白的检测
外泌体(直径为30-100纳米)和微粒体(直径为100-1000纳米)是由大多数哺乳动物细胞分泌的小泡,并携带因子进行细胞间的通信。肿瘤可释放外泌体和微粒体携带特定蛋白质、mRNA、miRNA和DNA,这些肿瘤分泌囊泡,特别是外泌体,是无创诊断的潜在生物标志物。
使用外泌体作为标记物大有希望克服当前仍然存在于癌症检测的技术挑战,如早期检测的难度,侵入性筛选,低特异性,和假阳性结果。然而,由于这些纳米级别分子成分多样的外泌体与其他细胞外膜泡的分离和成分分析较为繁琐,加之血液中还含有各种各样的细胞存在,因此,基于外泌体的诊断仍然具有很大的挑战。
DNA甲基化
表观遗传学中,CpG(常见甲基化修饰位点)的甲基化是基因表达和组织分化的重要调控方式,癌症发病初期,DNA就可出线甲基化修饰改变,故通过分析甲基化模式,可推断出ctDNA的组织来源,甚至推断出肿瘤类型。
微生物组
有研究小组成员分析了112名接受抗PD-1免疫疗法的患者的口腔与肠道菌群。研究者们发现,PD-1免疫疗法应答者(R)与不应答者(NR)的肠道菌群的多样性和组成具有显著差异。通过病人粪便微生物的分析,R具有明显更高的α多样性和相对丰度的瘤胃球菌科细菌。
宏基因组研究揭示了R中肠道细菌的功能与NR差异较大,其体内的合成代谢通路更为丰富,系统免疫力与抗肿瘤免疫力也更强,这些数据对用免疫检查点抑制剂治疗黑素瘤患者具有重要意义。
总而言之,生物标志物可以协助判断预测治疗有效性。PD-L1与dMMR/MSI-H是目前进入临床实践的免疫治疗生物标志物,新的PD-1/PD-L1抑制剂疗效的预测标记物,如TMB、GEP、TILs等需要更多的临床研究证据支持。另外,液体活检Biomarker的探索也为未来提供了更为广泛的空间。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发