《Nature》:针对前列腺癌的PROTACs已进入临床试验!或将开启蛋白靶向降解治疗癌症新篇章!
| 导读 | 自PROTAC策略问世以来可谓备受关注,而在近日,Arvinas公司宣布,将于今年年中启动关于PROTAC策略治疗前列腺癌的临床试验,该试验将持续约9个月。 |
自PROTAC策略问世以来可谓备受关注,而在近日,Arvinas公司宣布,将于今年年中启动关于PROTAC策略治疗前列腺癌的临床试验,该试验将持续约9个月。 不仅如此,Arvinas公司还声称有体内证据表明PROTAC可降低小鼠大脑中的tau蛋白,将其tau蛋白质降解剂直接注入小鼠海马体后,将tau水平降低了50%。如此看来,PROTAC策略(蛋白质降解而不是抑制)可以作为未来阿尔茨海默病和癌症的一种通用而有力的治疗方法。

对于传统的小分子药物而言,它们的作用机理无外乎结合靶点蛋白,调节它们的功能。但这样的药物有着种种局限,无法作用于所有的蛋白靶点。而PROTAC的问世则为解决这些问题带来了极大的潜力:PROTAC是一种特殊的蛋白降解技术。蛋白降解靶向嵌合体(PROTACs)使用一个Linker,一端连接目标蛋白的抑制剂,另一端连接E3泛素连接酶的结合配体分子。PROTAC代表了一种化学敲低策略,将目标蛋白与E3连接酶拉拢,使得E3可以泛素化标记目标降解蛋白,然后通过蛋白酶体降解目标蛋白,这能有效规避传统小分子药物的短板,有着巨大的应用潜力。
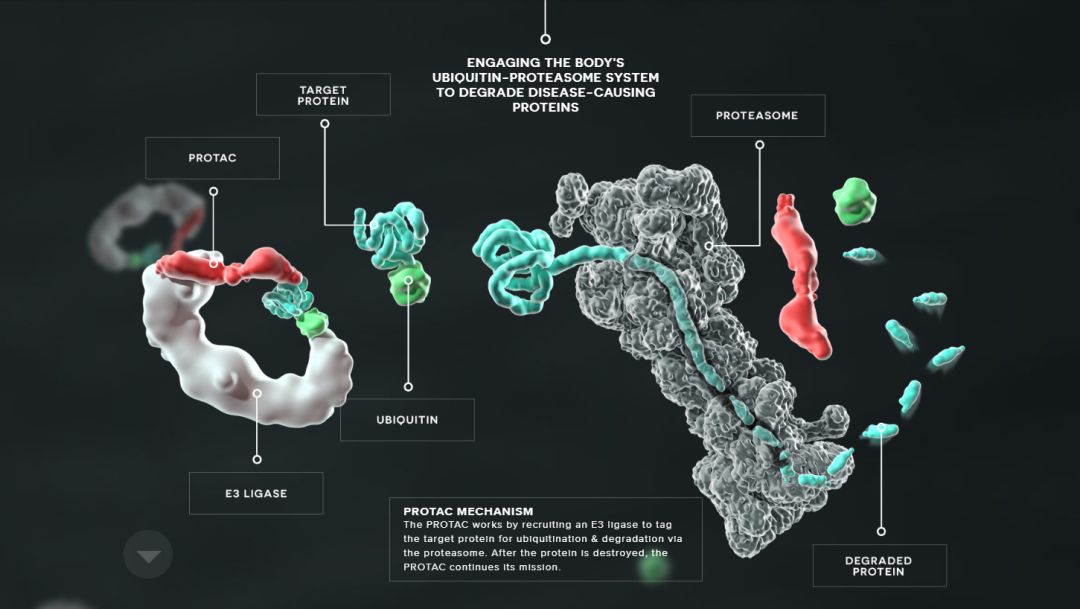
去年至今,PROTAC领域可谓是遍地开花,取得了优异的成果:
2018年:
《Cell Research》期刊报道了通过构建新型BTK蛋白高效降解剂,克服了临床上B细胞恶性肿瘤由于BTK蛋白突变引起的对临床一线药物Ibrutinib的耐药性,新策略的靶向选择性远优于Ibrutinib,能够避免Ibrutinib产生的严重副作用;
《ChemComm》报道了利用了不同的招募PARP1蛋白和E3连接酶的配体组合,实现了利用PROTAC技术靶向降解PARP1蛋白;
2019年:
《Protein & Cell》期刊报道通过构建新型HDAC6选择性的高效降解剂,实现了在多种肿瘤细胞系中对HDAC6的高效降解,且该降解剂能够降解EGFP融合蛋白,证明可以利用荧光手段在细胞层面实现蛋白降解过程的动态监测;
《Cell Discovery》报道通过化学设计蛋白降解分子(PROTACs),快速可逆敲低动物体内蛋白(FKBP12),并首次成功实现恒河猴体内蛋白全身快速敲降;
《Leukemia》报道通过构建新型高溶解度的BTK蛋白高效降解剂,成功高效的降解多种临床相关的突变型BTK蛋白,在体内实验中克服了临床上非霍奇金淋巴瘤由于BTK蛋白突变引起的对临床一线药物ibrutinib的耐药性。
目前,PROTAC主要用于发现新的抗癌剂,因为它们具有优于经典抑制剂的独特优势。Arvinas公司将开始为使用ARV-110治疗前列腺癌患者的1期临床试验招募患者。ARV-110是一款双功能分子,分子的一端可以与靶标结合——对于这种在研疗法来说是雄激素受体(AR)。而它的另一端可以与E3泛素连接酶结合。连接酶可以为靶标“贴上”泛素的标签,让靶标蛋白被运送到细胞的蛋白酶体进行降解。
靶向降解剂最大的理论优势是他们能够让原先无法成药的靶标可以被药物靶向。像其它靶向降解剂一样,ARV-110的活性是基于对靶标蛋白降解过程的催化。这意味着,Arvinas的候选药物可以少于靶标蛋白,而通常的小分子抑制剂的数量要多于靶标。
降低药物的使用剂量可能带来更好的副作用特征,另一个靶向降解剂的优势在于,即使药物被排出,它们的作用仍然可以得到延续,直到细胞重新合成被降解的蛋白为止。
当这些临床试验结束后,人们将关注这些非常规降解剂化合物的吸收、分布、代谢和清除特性,看看它们的表现能否达到口服施药的预期。这一领域同时想知道这些药物能够将蛋白水平降低到什么程度,蛋白降解的速度与蛋白的重新合成速度之间的对比,以及这些数据和动物模型中的数据是否吻合。
未来,将是PROTAC的时代,2019年到2021年将是这一领域爆发的时期。这项技术已经吸引了包括Arvinas,C4 Therapeutics和Kymera Therapeutics等公司专注于改良靶向降解剂的化学特性。该技术给我们带来了无限的可能,这可能是药物开发领域最具颠覆性的技术。让我们拭目以待。
参考文献:
Protein-slaying drugs could be the next blockbuster therapies 20 March 2019(转化医学网360zhyx.com)
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发