眼见为实!看金纳米星如何递送药物至癌细胞
| 导读 | 近日,西北大学的一个研究小组开发了一种新的方法,可以通过实时对比分析单个靶向性和非靶向性金纳米颗粒在细胞膜和细胞内的运动模式,来确定单个药物输送纳米颗粒能否到达预期靶标。 |
作者:Blake
近日,西北大学的一个研究小组开发了一种新的方法,可以通过实时对比分析单个靶向性和非靶向性金纳米颗粒在细胞膜和细胞内的运动模式,来确定单个药物输送纳米颗粒能否到达预期靶标。同时,该小组设计了新的成像系统,可以通过比较不同性质的纳米颗粒与细胞的相互作用,来设计更好的靶向性药物递送载体。

靶向给药系统能够让药物在病变部位聚集,避免了对正常组织的毒性,对治疗癌症具有重要的应用前景。纳米颗粒(nanoparticle,NP)是一种重要的靶向给药载体,为了使纳米颗粒具有靶向性,可将纳米颗粒和一些可识别细胞膜表面受体的配体结合。
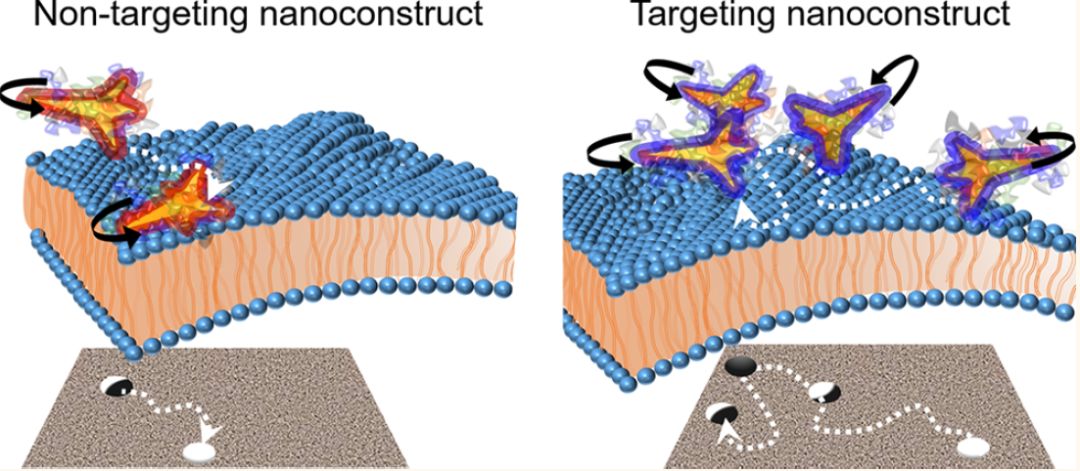
通过观察载药金纳米星(Au nanostar,AuNS)在癌细胞膜上的平移动力学模式,研究人员发现,靶向癌细胞标志物的金纳米星在细胞内运动路径更长,旋转速度也比非靶向金纳米颗粒快得多。即使被非特异性吸附的蛋白质包围,靶向纳米星仍保持其独特的特征运动,这表明它们的靶向能力不会受到蛋白冠的限制。
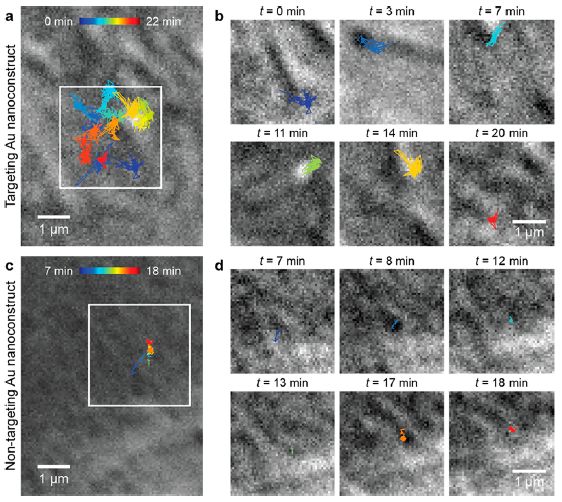
金纳米星(AuNS)在N87细胞膜上的平移动力学。(a) 靶向性纳米颗粒在细胞膜上运动轨迹的微分干涉相衬显微镜(DIC)成像。(b)靶向性纳米颗粒在6个不同连续时间间隔的运动轨迹成像。(c) 非靶向性纳米颗粒在细胞膜上运动轨迹的微分干涉相衬显微镜(DIC)成像。(d)非靶向性纳米颗粒在6个不同连续时间间隔的运动轨迹成像。
同时,研究人员发现单个靶向性纳米金受体介导的内吞作用的动力学模式,并发现靶向性纳米金在胞内间断性运动。这些数据为不同性质纳米颗粒和细胞作用机理研究提供了支撑。
主导这项研究的Odom教授说:“进一步来说,通过微分干涉相衬显微镜(DIC)成像得到的信息可以用来比较不同的纳米颗粒特征,如粒径、形状和表面化学,进而优化纳米颗粒的设计,以设计更好的靶向药物递送载体。”
长期以来,医学界一直在寻找当前癌症治疗的替代方法,如化疗和放射疗法的替代方法,这些疗法除了会杀伤癌细胞外,对健康组织也有有一定的毒性。与目前的全身系统性给药方法相比,直接将药物靶向输送到病变区域显然副作用更少。
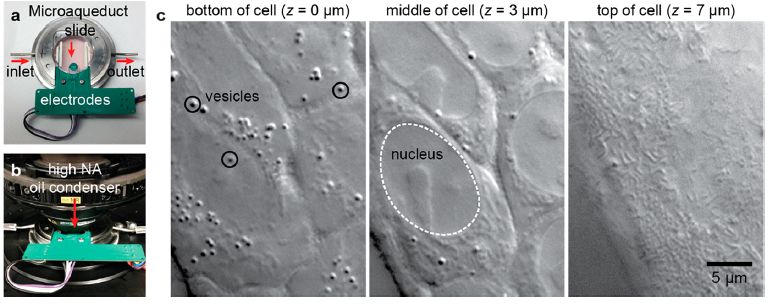
Odom团队改装的活细胞微分干涉相衬显微成像系统(DIC)。(a)(b)灌注室。(c)DIC在不同z-heights下对N87细胞的成像。(转化医学网360zhyx.com)
参考文献:
[1] Resolving Single-Nanoconstruct Dynamics during Targeting and Nontargeting Live-Cell Membrane Interactions. (ACS Nano,2019)
DOI: 10.1021/acsnano.9b03144
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发