Science子刊:新联合疗法截断肿瘤免疫逃逸之路
| 导读 | KRAS原癌基因突变在很多癌症中很常见。MEK和IGF1R抑制剂的联用对具有KRAS突变的癌症很有效,但部分癌症患者疗效较差。 |
KRAS原癌基因突变在很多癌症中很常见。MEK和IGF1R抑制剂的联用对具有KRAS突变的癌症很有效,但部分癌症患者疗效较差。近日,研究人员利用功能基因组筛选技术发现了针对肿瘤免疫逃逸的药物联用方法,在该联合疗法中将MEK抑制剂替换为突变型KRAS抑制剂(KRAS-G12C和IGF1R、mTOR抑制剂三联)可降低毒性,而且在小鼠模型中有很好的疗效及耐受性,为KRAS-G12C突变的联合治疗方案提供了新的思路。

KRAS基因是在人体内克隆的第一个原癌基因。KRAS基因发生突变后会导致KRAS蛋白质一直处于激活状态,导致细胞恶性增殖,进而导致肿瘤发生。
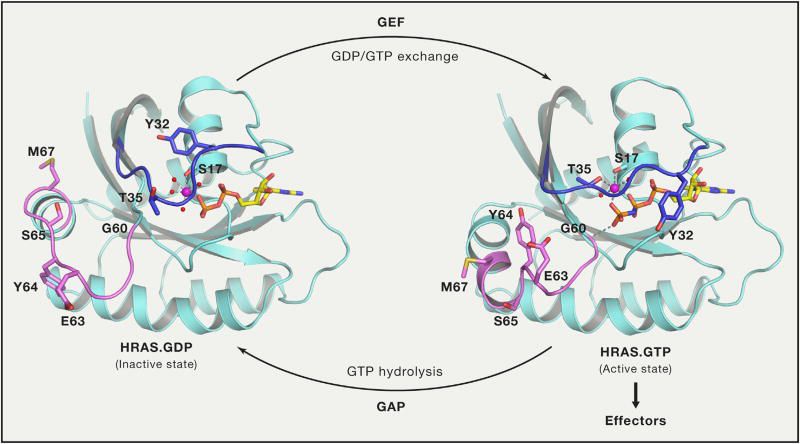
RAS激活与非激活状态切换示意图
药物联用是降低肿瘤免疫逃逸、提高疗效的常用方法。在前期的研究中,研究人员发现KRAS突变的肺腺癌细胞对MEK、IGF1R信号抑制很敏感。为了寻找影响MEK、IGF1R联合使用效果的信号通路,研究人员通过功能基因组筛选(functional genomic screen)技术发现MEK、IGF1R联合使用效果可通过同时抑制mTOR来增强,而且MEK、IGF1R、mTOR抑制剂联用对KRAS突变具有特异性。
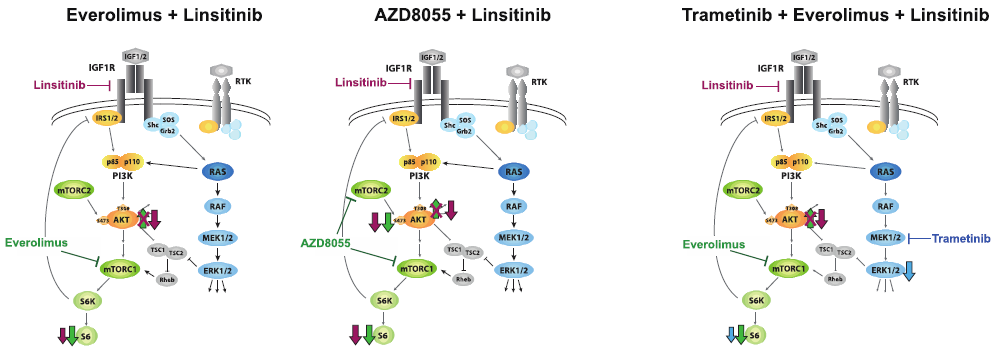
联合使用IGF1R、mTOR、MEK抑制剂阻断PI3K/AKT、mTOR信号通路示意图(左、中:IGF1R、mTOR抑制剂;右:IGF1R、mTOR、MEK抑制剂)
为了进一步验证全基因组shRNA筛选结果,研究人员构建了三个KRAS突变的小鼠肺癌模型,结果显示,mTOR、IGF1R、MEK三种抑制剂的联合使用确实可导致肿瘤消退,证明联合使用可抑制KRAS突变细胞生存的主要信号通路。
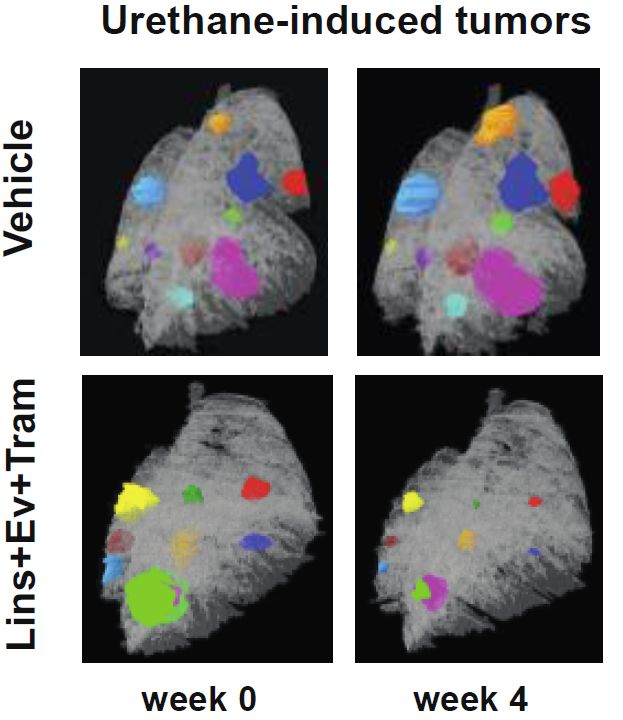
联合使用mTOR、IGF1R 和MEK抑制剂导致KRAS突变肿瘤消退
虽然上述联合方案可使KRAS突变肿瘤消退,但这种方案的MEK抑制剂具有较大毒性。为了解决这个问题,研究人员将上述联合方法中的MEK抑制剂替换为ARS-1620(KRAS-G12C突变特异性抑制剂),发现这种新的联合方法(KRAS-G12C和IGF1R、mTOR抑制剂三联)具有更好的有效性、特异性以及耐受性。
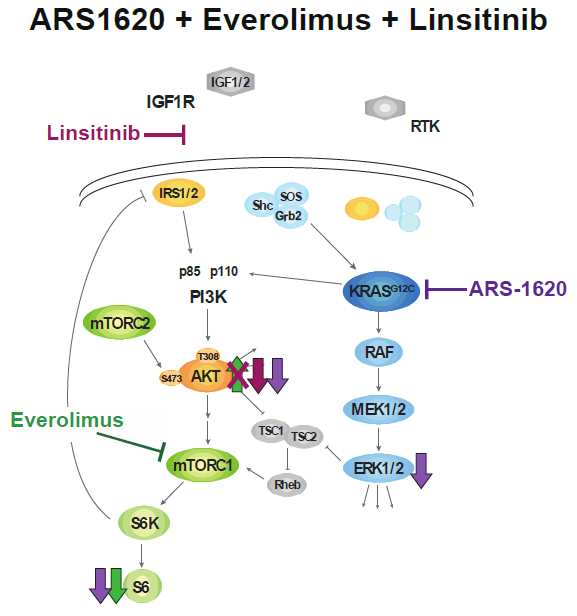
联合使用KRAS-G12C、IGF1R、mTOR抑制剂的信号通路阻断示意图
随后,研究人员对这种联合方法进行了体外实验和体内实验(小鼠模型)的验证。结果显示,mTOR、IGF1R抑制剂联合ARS-1620与单独使用ARS-1620相比,联合使用显著提高了KRAS-G12C突变肺癌的有效性。
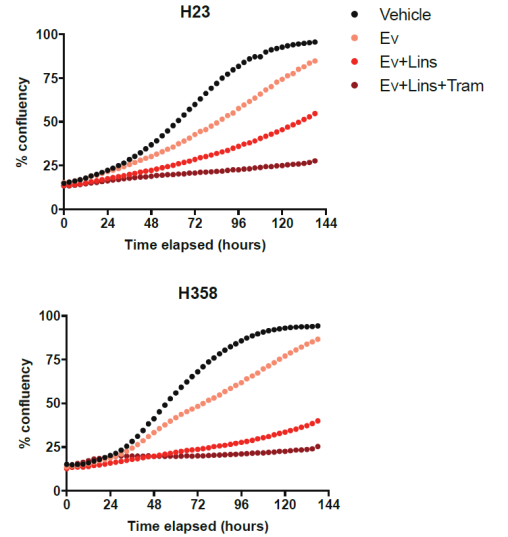
体外实验:联合使用KRAS-G12C抑制剂抑制导致KRAS突变细胞系(H23、H358)活性降低(X轴为时间/h,Y轴为细胞融合度)
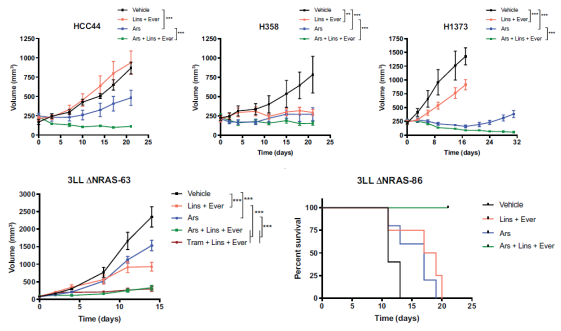
体内实验:KRAS-G12C和IGF1R、mTOR抑制剂联合使用可增强体内实验效果。1、上排分别为三种细胞系HCC44、H358、H1373的小鼠模型,对其进行ARS-1620、linsitinib、everolimus(依维莫司)三种药物单独或联合治疗,肿瘤体积随天数的变化曲线。2、下排为敲除NRAS基因的3LL细胞系3LLΔNRAS的小鼠模型,对其进行ARS-1620、linsitinib、everolimus(依维莫司)三种药物单独或联合治疗,左图为3LLΔNRAS-63小鼠模型肿瘤体积变化曲线,右图为3LLΔNRAS-86小鼠生存曲线
目前针对KRAS-G12C突变的抑制剂已经进入临床,比如MRTX849(NCT03785249)和AMG510(NCT03600883),近日WCLC大会上AMG510的I期临床显示较好的结果(ORR 54%,DCR 100%),而且AMG510与PD-1单抗联用的临床试验正在准备中。该研究为即将到来的KRAS-G12C抑制剂的临床联合方案提供了重要的数据支撑。
参考文献:
[1] Development of combination therapies to maximize the impact of KRAS-G12C inhibitors in lung cancer. 2019. Science Translational Medicine.
DOI: 10.1126/scitranslmed.aaw7999
[2] RAS Proteins and Their Regulators in Human Disease. 2018. Cell.
DOI: 10.1016/j.cell.2017.06.009

(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发