Cell Reports:新的胰腺癌联合治疗方案可逆转肿瘤微环境!
| 导读 | 近日,罗切斯特大学的研究人员提出了一种新的联合疗法,该疗法将一种放射疗法和一种免疫疗法结合,不仅可以治愈小鼠的胰腺癌,而且还可以重编程小鼠免疫系统,形成“免疫记忆”,产生类似肿瘤原位疫苗的治疗效果。该研究为晚期胰腺癌的临床试验设计提供了重要的指导意义。 |
近日,罗切斯特大学的研究人员提出了一种新的联合疗法,该疗法将一种放射疗法和一种免疫疗法结合,不仅可以治愈小鼠的胰腺癌,而且还可以重编程小鼠免疫系统,形成“免疫记忆”,产生类似肿瘤原位疫苗的治疗效果。该研究为晚期胰腺癌的临床试验设计提供了重要的指导意义。

胰腺癌是一种侵袭性很强且生存率很低的癌症。超过80%的患者确诊时已经是晚期,不能通过手术切除肿瘤组织,而化疗仅仅能稳定病情。
胰腺癌具有较多的结缔组织和致密间质,营养失衡且匮乏,这种微环境可以一方面可以保护癌细胞免受免疫系统攻击,另一方面也使得药物难以进入,导致胰腺癌很难治疗。
体部立体定向放疗(SBRT)可在短时间内提供高剂量的辐射,激发免疫系统并杀死癌细胞,作为一种新的治疗PDA的辅助手段,具有良好的前景。白细胞介素-12(IL-12)具有抗癌活性,也能激活免疫系统。然而,IL-12常常伴随着严重的副作用。而一种新的定时释放技术-局部白细胞介素-12微球(IL-12 MS)可以在两周内缓慢释放药物,降低其副作用。
该研究中,研究人员将SBRT和IL-12 MS免疫治疗相结合,并在胰腺癌的小鼠模型中研究了其治疗效果。
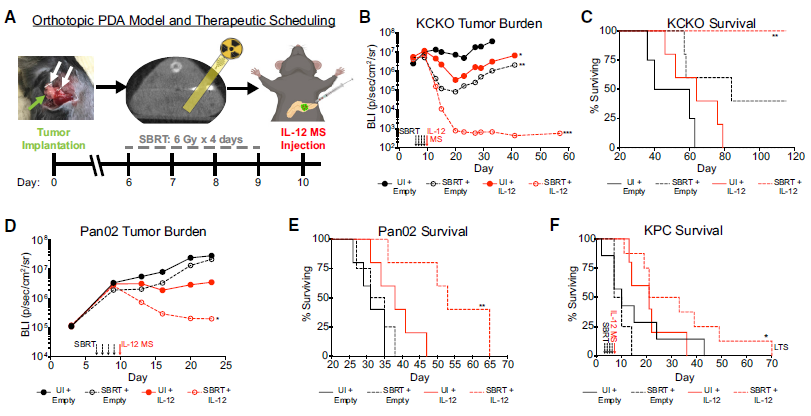
体内实验表明,SBRT/IL-12 MS联合治疗可大大降低肿瘤负荷并延长生存期
研究人员构建了多个胰腺癌小鼠肿瘤模型,发现与常规放射治疗(Con-RT)相比,SBRT可招募CD8T细胞到人胰腺癌肿瘤中心部位。与对照及单独治疗组相比,SBRT和IL-12 MS联合治疗可大大降低肿瘤负荷并延长生存期。随后,研究人员发现SBRT/IL-12 MS通过提高肿瘤内IFN-γ水平来实现治疗效果,并可重编程骨髓来源的抑制性细胞、消除CD4调节性T细胞,从而提高杀伤性CD8+T细胞的比例。
此外,SBRT/IL-12MS治疗可产生系统性肿瘤免疫反应,引起远端效应,消除胰腺癌的肝转移,明显降低肝转移的发生率。
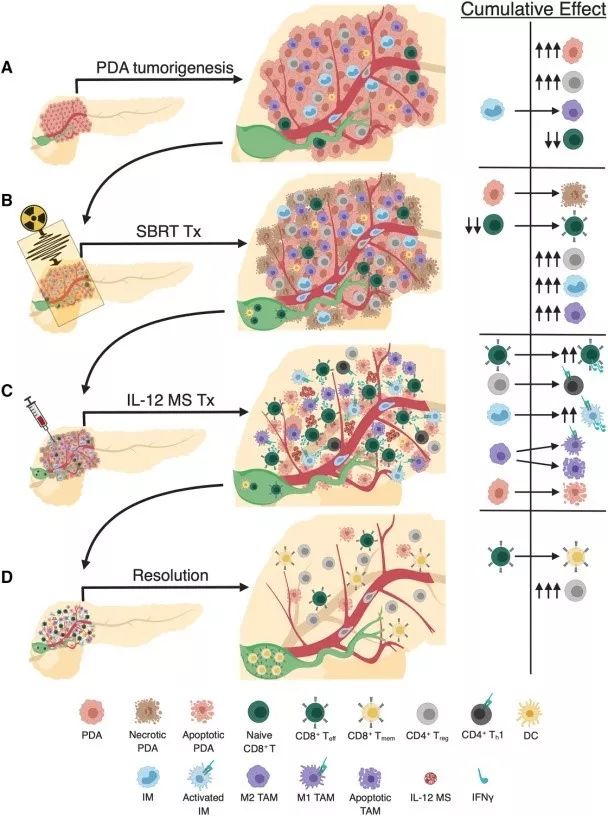
SBRT/IL-12 MS联合治疗PDA示意图
(A)PDA肿瘤发生的特征为免疫抑制性Treg细胞的浸润,外周血中CD8 T细胞的减少等。
(B)SBRT导致细胞死亡,产生肿瘤抗原,导致DLN(绿色)中Teff产生,肿瘤内杀伤性CD8 Teff细胞增加,但抑制性Treg和IM/TAM细胞也增加。
(C)IL-12 MS治疗诱导肿瘤内T细胞产生IFNγ,引起Treg向Th1再极化,激活IMs以及TAMs中M1的重编程。Teff细胞的增加导致明显的肿瘤细胞凋亡。
(D)PDA肿瘤消退,Treg回升,Tmem形成,产生持续的肿瘤特异性免疫记忆。
近年来,由于临床试验效果欠佳,常规放射治疗胰腺癌逐渐失去创新性,而几十年的研究表明导致放疗效果差的主要原因是肿瘤免疫抑制。该研究联合了两种新兴疗法:SBRT和免疫治疗。该联合疗法可在肿瘤部位引起类似肿瘤疫苗的反应,其中SBRT可以看作是一种在肿瘤部位产生新生抗原的方法,而IL-12 MS则可驱动免疫反应,二者联合可产生了系统性的免疫反应。该研究为不可切除的晚期胰腺癌的临床试验设计提供了重要的指导意义。
参考文献:
Bradley N. Mills et al, Stereotactic Body Radiation and Interleukin-12 Combination Therapy Eradicates Pancreatic Tumors by Repolarizing the Immune Microenvironment, Cell Reports (2019).
DOI: 10.1016/j.celrep.2019.08.095
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发