Science子刊:肝脏芯片可准确预测多物种药物毒性,加速药物筛选!
| 导读 | 药物毒理学实验是确保药物安全性的关键,然而,目前标准临床前模型无法准确预测药物性肝损伤。 |

药物毒理学实验是确保药物安全性的关键,然而,目前标准临床前模型无法准确预测药物性肝损伤。为了更加快速有效的进行药物的筛选,研究人员开发了一种新型多物种肝脏芯片,该芯片由大鼠、犬或人的肝细胞、内皮细胞、枯否细胞和星形细胞组成,能够识别物种间药物代谢和毒性的差异,快速有效的进行药物肝毒性筛选,从而显著降低新药问世的时间和成本。

新药研发临床试验前,需要对药物的毒性进行评估,尤其是对于药物代谢和清除起重要作用的肝脏毒性。而动物实验模型的预测结果并不能精确反映药物毒性,导致临床试验的失败甚至已获批药物从市场召回。而器官芯片的出现,为药物发现、药物毒性评估提供了一个更准确的转化平台。
最近,FDA发布了预测性毒理实验路线图(Predictive Toxicology Roadmap),以评估体外模型、数学模型这些新型毒理学实验方法,并鼓励用这些方法来辅助、代替动物实验。
利用器官芯片技术构建的体外模型对评估药物性肝损伤具有一些显著的优势,但依然存在一些问题。比如,体外培养的肝细胞缺乏代谢能力,虽然一些复杂的2D和3D培养技术可延长肝细胞的代谢能力,但这些模型是静止和封闭的,因此代谢物浓度会升高到非生理水平,而且由于缺乏培养基的补充,细胞可能缺乏营养而死亡。而且,3D培养的细胞结构紧密,会导致缺氧及营养物质运输问题。
针对这些问题,Emulate公司开发了一种新型肝脏芯片,并发表在近的《Science Translational Medicine》期刊上。该芯片技术最初源于哈佛韦斯研究所,为了将此技术快速转化应用,成立了Emulate公司。
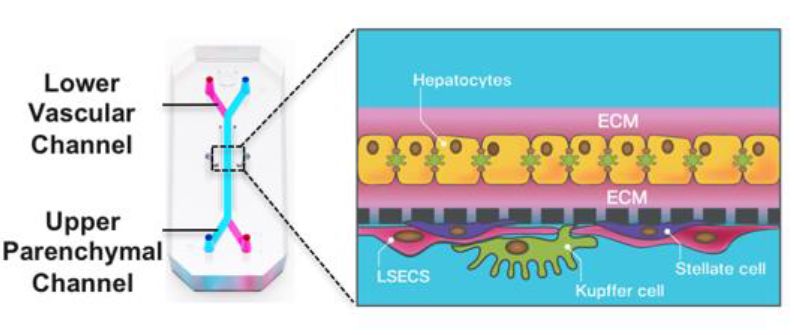
肝脏芯片示意图。该芯片具有多层肝脏细胞结构,原代肝细胞位于上层细胞外基质(ECM)夹心的实质细胞通道,肝非实质细胞(窦内皮细胞,枯否细胞,星形细胞)位于膜下层血管通道
该芯片采用微流控技术,保证了所有的细胞一直处于理想浓度水平的药物及药物代谢物中,并可通过简单的调节流速来调节药物浓度。这种开放性系统可以连续不断的从芯片血管通道和实质通道中取样,从而保证了实时生物标志物检测。由此产生的实验结果与动物实验和临床试验结果更为接近。
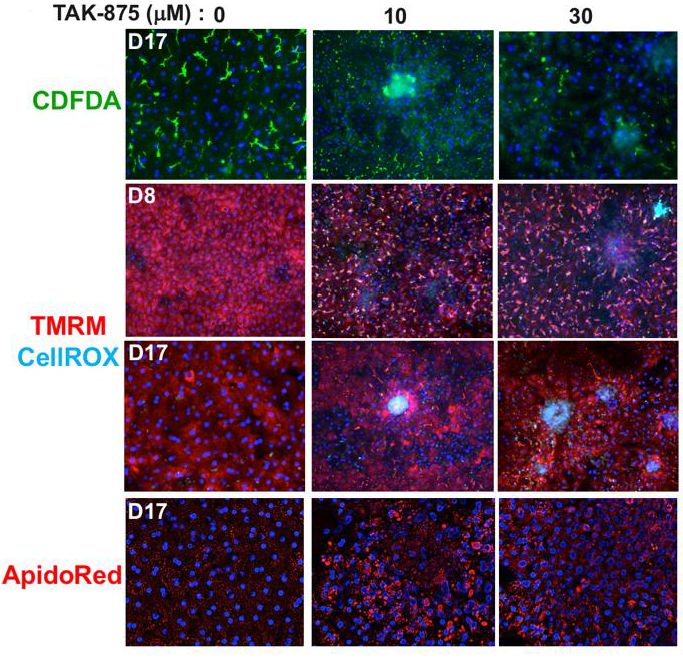
研究人员利用该芯片研究药物作用,如药物TAK-875对肝脏健康、线粒体功能(红色)以及活性氧(蓝绿色)的影响
通过该芯片,研究人员证实了几种已知具有肝毒性的药物和化合物的作用机制。并发现一种化合物在大鼠肝脏芯片中可诱导肝纤维化,但对人肝脏芯片中的肝细胞没有影响,而另一种化合物在犬肝脏芯片中表现出了更大的毒性。
物种特异性肝脏芯片可用来预测药物对大鼠、犬和人的肝脏毒性,因此对于那些在动物实验中不具有肝毒性的药物,可以在开展临床试验前利用该芯片对其进一步评估,如果药物对人肝脏具有特异性毒性,该芯片也有助于进一步揭示其机理。
目前,Emulate公司正在对其器官芯片产品进行市场布局,这些芯片可以作为制药行业、生物技术行业,以及化妆品行业的人体相关预测模型,并计划未来将产品用于疾病模型研究。
参考文献:
Reproducing human and cross-species drug toxicities using Liver-Chips. Credit: K.-J. Jang et al., Science Translational Medicine (2019)
https://medicalxpress.com/news/2019-11-liver-chip-drug-toxicities-human-rat.html
推荐阅读:
-
强强联手!新组合用药有望“创造”靶点,实现对癌症“围追堵截”
-
这些被忽视的免疫细胞,竟是乳腺癌细胞治疗的“潜力股”!
-
Science子刊:深挖“双面蛋白”沦为肿瘤免疫逃逸帮凶的真相
-
Cancer Cell:基于多蛋白复合物的癌症精准治疗范式,有望攻克一半以上的肿瘤
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发