《自然·医学》:胶质母细胞瘤免疫治疗老是耐药?靶向这个基因准没错!
| 导读 | 胶质母细胞瘤(GBM)是中枢神经系统最常见和侵袭能力最强的原发性恶性脑肿瘤,预后极差。 |
胶质母细胞瘤(GBM)是中枢神经系统最常见和侵袭能力最强的原发性恶性脑肿瘤,预后极差。标准治疗方案无法安全、特异地消除所有癌细胞,仅能提供给患者有限的生存获益。免疫治疗通过特异性识别和杀伤肿瘤细胞,为GBM治疗开辟了新道路。但是,GBM并不会任人宰割,肿瘤微环境(TME)会对免疫效应细胞产生一系列抑制作用,导致该疗法疗效难尽如人意。近日,德克萨斯大学MD安德森癌症中心的研究人员发现了GBM获得性耐药的关键——CD73。他们指出,CD73抑制剂与PD-1/PDL-1抑制剂和CTLA-4抑制剂的强力联合,可显著抑制GBM生长,提高患者生存率。

GBM具有高度免疫抑制的TME,其中CD73介导的代谢通路是GBM常年处于“低温”的重要原因之一。CD73是NT5E基因编码的胞外-5'-核苷酸酶,可通抑制LCK、MAPK、PKC等一系列与免疫激活相关的信号通路,进而调控调节性T细胞、抑制炎症途径,发挥广泛的免疫抑制活性。
研究人员指出,在GBM中,CD73分子由糖基磷脂酰肌醇(GPI)锚定于细胞膜外表面,表达量显著高于其他实体瘤,不仅参与嘌呤核苷酸的代谢和补救合成途径,作为一种重要的免疫信号负调控分子,还参与肿瘤的免疫逃逸。
在TME中,CD73可产生免疫抑制性介质腺苷(ADO),ADO可通过其特定的G蛋白偶联受体削弱抗肿瘤免疫应答中的CD8+细胞和自然杀伤(NK)细胞,从而促进肿瘤发生、发展。ADO作为一种重要的免疫抑制性介质,其在TME中的蓄积是肿瘤发生免疫逃逸的重要因素之一。ADO作为固有免疫和适应性免疫调节过程中的关键性效应分子,可以与多种免疫细胞表面的腺苷受体(A2A)结合,介导免疫细胞内的cAMP增加,从而抑制效应T细胞受体(TCR)介导的CD25上调,进而抑制了免疫细胞的增殖和免疫因子的释放,同时使其产生各种细胞毒性因子,促进肿瘤的生长、增殖和转移。
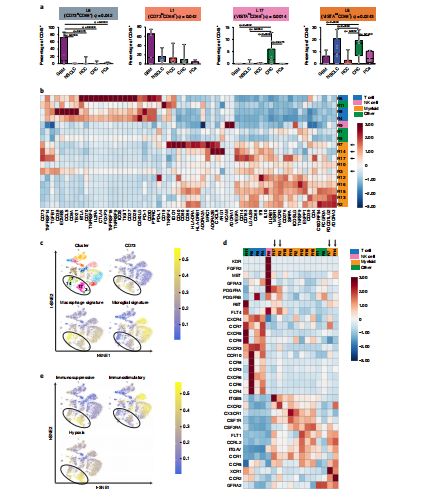
GBM中广泛存在CD73过表达的细胞
那么,CD73为何能在GBM的TME中“耀武扬威”呢?CD73也不是随便就表达的,最重要的一个条件是——低氧,而低氧是TME的一个重要特征。低氧可通过诱导HIF-1上调使得CD73广泛表达。无论是传统疗法还是免疫疗法,低氧或ATP富集都是必经之路,这就容易引发CD73-腺苷信号的级联反应,继而抑制T细胞功能。因为免疫反应CD73属于“自己人”,所以免疫反应也无法将其清除。最重要的效应细胞被压制,疗效自然难尽如人意。
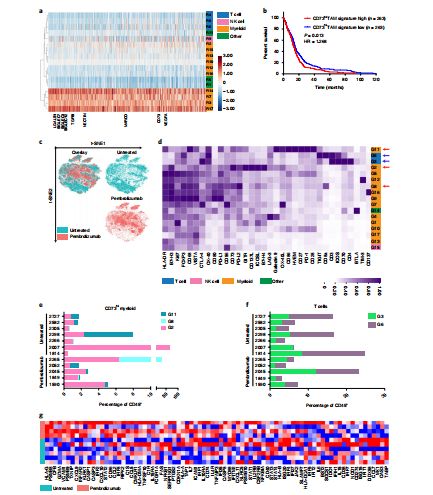
CD73过表达与GBM小鼠生存率降低有关
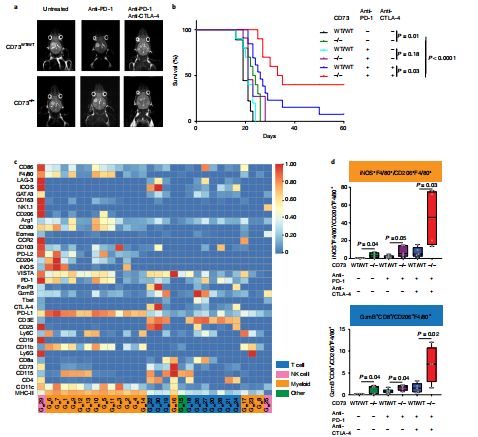
CD73敲除增强免疫治疗效应
研究人员发现,在敲除CD73基因的GBM小鼠中,联合使用抗PD-1和抗CTLA-4免疫疗法可抑制肿瘤生长并提高生存率。实验结果显示,阻断CD73分子不仅能够有效激活抗肿瘤免疫反应,还能够显著提高PD-1/PD-L1抗体与CTLA-4抗体对GBM的临床疗效。他们还指出,CD73过表达与较短生存期相关,这是能与PD-1/PD-L1和CTLA-4产生协同效应的新一代肿瘤免疫靶点,其带来的潜在的治疗契机令人期待。
这项研究描述了CD73过表达与GBM免疫获得性耐药的关系,证明了CD73-腺苷途径在肿瘤进展和免疫逃逸中不容忽视的作用,也为GBM免疫治疗提供了一个新靶点。同时,CD73有望成为患者预后及疗效标志物,也为患者治疗方案的选择带来了新的思路。(转化医学网360zhyx.com)
参考文献:
Sangeeta Goswami,et al.Immune profiling of human tumors identifies CD73 as a combinatorial target in glioblastoma.Nature Medicine (2019).
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发