【PNAS】西湖大学马仙珏/李旭课题组揭示UPR调控Hippo信号通路介导肿瘤进展新机制
| 导读 | 未折叠蛋白质反应(UPR)被认为通过控制内质网(ER)蛋白平衡来协调细胞生长和增殖,然而,这一过程背后的机制尚不清楚。因此,研究人员通过使用果蝇,哺乳动物模型和人类数据库,发现了Ire1 / Xbp1s在发育和肿瘤发生中的双重作用。 |
2022年10月10日,西湖大学生命科学学院马仙珏课题组与李旭课题组合作发表了研究论文,阐述了UPR的Ire1/Xbp1s分支通过Hippo通路调控器官大小、肠道干细胞稳态、细胞迁移和肿瘤发生发展的分子机制。同时,该文揭示了Bip与Yorkie/YAP互作决定了Ire1/Xbp1s在原发性肿瘤的生长和侵袭中具有双重功能。该研究发布于《Proceedings of the National Academy of Sciences》。

https://www.pnas.org/doi/epdf/10.1073/pnas.2202133119
肿瘤内激活UPR机制尚不清楚
01
发育过程中细胞生长和增殖依赖于蛋白质的大量合成,在这一高强度的加工过程中难免产生由于蛋白质翻译过程中的随机误差、折叠失败等原因造成的错误折叠蛋白。内质网作为蛋白质加工的工厂,能够缓解蛋白质合成及折叠的压力以协调细胞快速分裂增殖,从而维持机体稳态。
当内质网压力超过一定阈值,UPR的激活无法缓解内质网压力时,则将引发细胞凋亡。癌细胞在恶性增殖过程中同样需要大量的蛋白合成,因此有研究表明肿瘤中也会激活UPR,然而这一过程背后的机制尚不清楚。
果蝇,哺乳动物模型
02
在这项研究中,研究人员首先在果蝇中构建不同类型的恶性肿瘤模型,发现UPR均被显著激活。UPR激活可通过内质网膜上的三个跨膜“传感器”蛋白(Ire1、Perk和Atf6)启动一系列从内质网到核的信号转导途径来重建内质网稳态。为探究UPR各个分支在肿瘤发生发展中的作用,研究者采用基因过表达和RNA干扰技术,发现过表达Ire1/Xbp1s特异地激活Hippo信号通路从而抑制肿瘤生长。

研究人员通过遗传分析还发现,Hippo信号通路下游效应器Yorkie在Ire1/Xbp1调控器官大小中是必需的。在接下来的工作中,作者进一步发现Bip作为Xbp1s的下游关键调节因子,可通过与Yorkie相互作用,使其锚定在细胞质,限制其入核,从而调控器官大小和抑制肿瘤生长。另外,他们还发现存在一种UPR信号调控Hippo信号通路的负反馈制衡机制。
Ire1的双重作用
03
此外,果蝇肠道上皮的建立和维持需要严格控制肠道干细胞的增殖和分化,这种细胞稳态的破坏会导致肠道功能异常,如肿瘤生长。在正常内稳态和损伤重建期间,Ire1/Xbp1s/Bip通过抑制果蝇成体肠道组织中的Yorkie信号活性,从而调节肠道干细胞数量。

在Xbp1缺失的果蝇肿瘤模型中,肿瘤体积增大的同时肿瘤的侵袭却被显著抑制。研究人员进一步利用翅成虫盘作为研究细胞侵袭和上皮间充质转化的体内模型,发现Ire1/Xbp1s由于抑制了Yorkie-dMyc/dMax和Yorkie-bantam途径,反而激活了JNK信号通路,从而促进生理性的细胞迁移和肿瘤发生中的细胞侵袭以及上皮间充质转化。
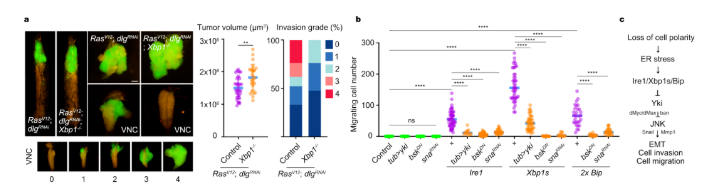
最后,他们通过生物信息学分析发现,XBP1表达水平在三阴性乳腺癌显著低表达,反而在其他四种乳腺癌亚型中显著高表达。
总之,研究揭示UPR的Ire1/Xbp1s分支通过调控Hippo信号通路,在器官大小,肠道稳态,细胞迁移和肿瘤发生发展中具有重要作用。马仙珏团队的发现也揭示了XBP1s/HSPA5通路和YAP通路在原发性肿瘤的生长和转移中具有双重功能。(转化医学网360zhyx.com)

参考资料:
https://www.pnas.org/doi/epdf/10.1073/pnas.2202133119
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录




还没有人评论,赶快抢个沙发